Второй закон термодинамики является одним из основных принципов в науке о термодинамике. Он гласит, что в изолированной системе энтропия всегда увеличивается или остается неизменной со временем. Эта концепция имеет множество приложений и является основой для понимания процессов, происходящих в природе.
Дополнения к первому закону термодинамики раскрывают более глубокие идеи, связанные с энтропией и необратимостью процессов. Они позволяют нам понять, почему некоторые процессы являются необратимыми, и почему в природе существует направление изменения системы, которому она следует.
Эти дополнения открывают перед нами возможность понять, почему мы можем видеть, как лед тает, а не наоборот. Почему чашка с горячим кофе постепенно остывает, а не наоборот. Все эти процессы объясняются вторым законом термодинамики и его дополнениями к первому закону.
Второй закон термодинамики помогает нам понять необратимость процессов в мире. Он устанавливает фундаментальный принцип, который ограничивает эффективность процессов и определяет направление их изменения. Изучение этих принципов позволяет нам лучше понять работу природы и расширить наши возможности в создании новых технологий и улучшении существующих.
Второй закон термодинамики: дополнения
Однако, помимо этого основного утверждения, второй закон термодинамики имеет дополнения и важные следствия. Они помогают нам лучше понять, как происходят процессы в природе и уточнить понятие энтропии.
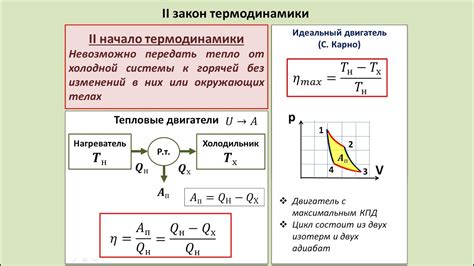
Одним из таких дополнений является теорема Клаузиуса, которая утверждает, что невозможно построить периодический двигатель, который работал бы с эффективностью 100%. Это значит, что при конвертации тепловой энергии в механическую часть теплоты всегда будет потеряна и превращена в бесполезную энергию.
Другим дополнением является импиковость процессов. Импиковость означает, что процессы в природе происходят без перерыва и непрерывно направлены от состояния с низкой энтропией к состоянию с высокой энтропией. Это объясняет постепенное увеличение энтропии замкнутой системы с течением времени.
Также второй закон термодинамики имеет важное следствие – закон убывания энергии. Он утверждает, что полезная энергия в системе со временем уменьшается, а бесполезная энергия, такая как теплота или шум, увеличивается. Это связано с тем, что процессы всегда сопровождаются потерей энергии, которую нельзя полностью использовать.
Таким образом, второй закон термодинамики не только позволяет нам понять направленность процессов в природе, но и вносит важные дополнения, объясняющие некоторые особенности энергетических систем. Понимание этих дополнений помогает нам более точно описать происходящие процессы и эффективно использовать энергию.
Энергия и ее перераспределение в системе

Перераспределение энергии в системе происходит в соответствии со вторым законом термодинамики. Он утверждает, что энтропия системы всегда стремится к увеличению. Энтропия - это мера хаоса или беспорядка в системе.
При перераспределении энергии в системе происходят различные процессы. Например, теплообмен позволяет энергии передаваться от одного объекта к другому. Это может осуществляться посредством теплопроводности, конвекции или излучения.
Кроме того, энергия может быть перераспределена в системе в форме работы. Работа - это сила, приложенная к объекту, перемещающемуся на определенном расстоянии. Различные виды работы, такие как механическая, электрическая, химическая и др., могут приводить к перемещению и перераспределению энергии в системе.
Важно отметить, что при перераспределении энергии в системе всегда происходят потери энергии в виде тепла или трения. Эти потери связаны с неизбежными неидеальностями и неравновесными процессами в системе.
- Таким образом, энергия и ее перераспределение играют важную роль в термодинамике и позволяют понять механизмы преобразования энергии в системах.
- Перераспределение энергии может происходить через теплообмен и работу.
- Потери энергии в виде тепла или трения всегда присутствуют при перераспределении энергии в системе.
Понимание энергии и ее перераспределения в системе имеет большое значение в различных областях, включая энергетику, физику, химию и инженерию. Изучение этих процессов помогает разрабатывать более эффективные системы и процессы, а также позволяет лучше понять природу и устройство физического мира.
Тепловое равновесие и энтропия
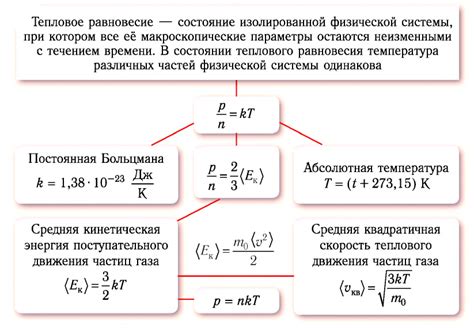
Энтропия - это величина, которая характеризует хаос или беспорядок системы. Второй закон термодинамики утверждает, что энтропия изолированной системы всегда увеличивается или остается постоянной, но никогда не уменьшается.
Когда система находится в тепловом равновесии, ее энтропия достигает максимального значения. Тепловое равновесие достигается, когда тепловые потоки внутри системы и между системой и окружающей средой сбалансированы. Это означает, что нет различия в температуре и давлении между различными частями системы.
Энтропия может быть рассчитана для таких состояний, как газы, жидкости и твердые тела. Развитие термодинамики позволяет нам понять, что тяжелые грузы всегда падают вниз, а не вверх, и почему кондиционер охлаждает нас или почему горячая чашка кофе постепенно остывает.
Таким образом, тепловое равновесие и энтропия являются основополагающими понятиями в термодинамике, которые помогают нам понять, как системы устанавливаются в равновесие и как изменяется степень их хаоса.
Направление процессов в открытых системах

В открытых системах, в отличие от закрытых или изолированных систем, процессы могут происходить не только в одном направлении, но и в противоположном. Это связано с тем, что в открытых системах происходит обмен веществом и энергией с окружающей средой.
Важным понятием при изучении направления процессов в открытых системах является химический потенциал. Химический потенциал определяет склонность вещества к протеканию химических реакций и влияет на направление теплового и вещественного потоков. Если химические потенциалы двух веществ различны, то процесс будет идти от вещества с более высоким потенциалом к веществу с более низким потенциалом.
Направление процессов в открытых системах также определяется вторым законом термодинамики. Согласно этому закону, энтропия системы всегда увеличивается или остается постоянной во время протекания процессов в закрытой системе. В открытой системе энтропия может увеличиваться, уменьшаться или оставаться постоянной, в зависимости от изменений, происходящих в системе.
В результате, процессы в открытых системах могут протекать в разных направлениях, в зависимости от различия химических потенциалов, концентраций веществ, температур и других факторов. Понимание направления процессов в открытых системах играет важную роль в различных областях науки и техники, включая химию, физику и биологию.
Тепловые двигатели и их эффективность
Основным принципом работы тепловых двигателей является преобразование тепловой энергии, полученной от нагревательного источника, в механическую работу. При этом, согласно второму закону термодинамики, часть энергии будет потеряна в виде тепла.
Эффективность теплового двигателя определяется способностью преобразовывать большую часть полученной теплоты в механическую работу. Высокая эффективность говорит о том, что двигатель эффективно использует тепловую энергию, минимизируя потери.
Второй закон термодинамики накладывает ограничения на эффективность тепловых двигателей, они не могут работать с абсолютной эффективностью. Максимальная эффективность теплового двигателя может быть определена с использованием КПД Карно. КПД Карно определяется отношением работы, совершаемой двигателем, к поступившей в него теплоте.
Однако, в реальных условиях работы теплового двигателя эффективность обычно ниже, чем КПД Карно. Это связано с различными потерями энергии в процессе, такими как тепловые потери, трение и неидеальности в работе двигателя.
Улучшение эффективности тепловых двигателей является важной задачей для экономии энергии и сокращения негативного воздействия на окружающую среду. Разработка новых технологий и материалов позволяет достичь более высокой эффективности и уменьшить потери энергии, что в итоге приводит к улучшению производительности и экологической эффективности тепловых двигателей.
Термодинамическое время и необратимые процессы
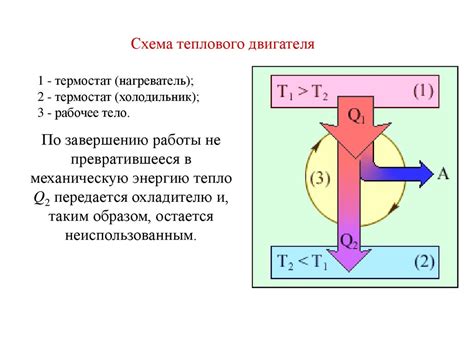
Второй закон термодинамики утверждает, что при естественных термодинамических процессах энтропия всегда увеличивается. Это означает, что в системе происходят необратимые процессы, которые нельзя изменить и вернуть в исходное состояние без внешнего воздействия.
Связанное с этим понятие - термодинамическое время. Термодинамическое время является нелинейной величиной, которая отражает степень необратимости процесса. Чем больше термодинамическое время, тем более необратимым является процесс.
Необратимые процессы имеют место при переносе энергии и тепла в системе. Такие процессы постепенно приводят к равновесию и невозможно вернуть систему в начальное состояние без внешнего воздействия. Примером необратимого процесса является трение, которое приводит к выделению тепла и распределению энергии.
Термодинамическое время и необратимые процессы имеют важное значение для практического применения термодинамики. Они помогают объяснить и предсказать процессы, которые происходят в реальных системах, и определить эффективность энергетических устройств. Вместе с первым законом термодинамики, второй закон и понятие термодинамического времени составляют фундаментальные основы термодинамики и универсальные законы природы.