Атомы состоят из ядра и облака электронов, которое окружает ядро. Электроны находятся на разных энергетических уровнях, которые различаются по энергии и удаленности от ядра. Наиболее внешний уровень электронов играет особую роль в химических реакциях и связях между атомами.
Внешний уровень электронов обычно содержит от одного до восьми электронов. На этом уровне электроны имеют наибольшую энергию и наибольшую вероятность взаимодействия с другими атомами. Иногда эти электроны называют валентными электронами, так как именно они участвуют в образовании химических связей.
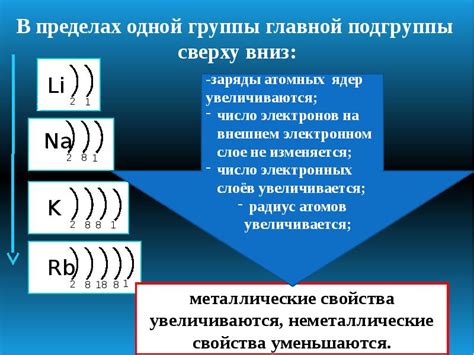
Валентные электроны возможно перемещаются между атомами в процессе химических реакций. Это позволяет образовывать химические связи, в результате чего образуются различные соединения. Знание количества валентных электронов позволяет предсказывать свойства и химическую активность атомов и соединений.
Изучение внешнего уровня электронов является важной частью химической науки и имеет широкий спектр практических применений. Понимание основных характеристик и свойств внешнего уровня электронов позволяет разрабатывать и прогнозировать новые материалы, лекарственные препараты и технологии.
Внешний уровень электронов в атоме играет ключевую роль во многих аспектах химии и имеет глубокое практическое значение.
Понимание и изучение внешнего уровня электронов открывает широкие возможности для развития науки и технологий в различных областях.
Внешний уровень электронов в атоме
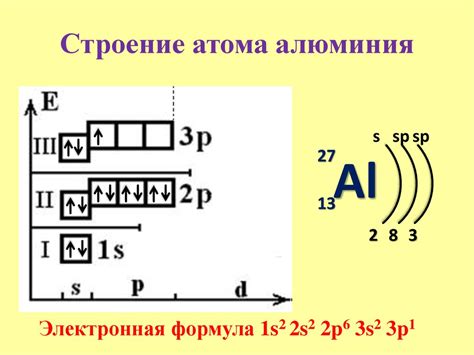
Количество электронов на внешнем уровне называется валентностью атома. Это число определяет, сколько электронов атом может принять или отдать при взаимодействии с другими атомами. Атомы стремятся достичь электронной конфигурации инертных газов (например, гелия), у которых на внешнем уровне находятся 8 электронов – полный комплект.
Валентность атома также определяет тип связи, которую он может образовывать с другими атомами. Атомы с валентностью 1 имеют тенденцию образовывать ионные связи, передавая или принимая электроны. Атомы с валентностью 2 и 3 обычно образуют ковалентные связи, в которых электроны общие.
Внешний уровень электронов также определяет химическую активность атома. Атомы с полностью заполненным внешним уровнем (восьмь электронов) являются инертными и не проявляют химическую активность. Атомы с неполностью заполненным внешним уровнем имеют большую склонность к химическим реакциям в попытке достичь более стабильной электронной конфигурации.
- Внешний уровень электронов определяет химические свойства атома.
- Количество электронов на внешнем уровне называется валентностью атома.
- Валентность атома определяет тип связи и его химическую активность.
Строение атома и его состав
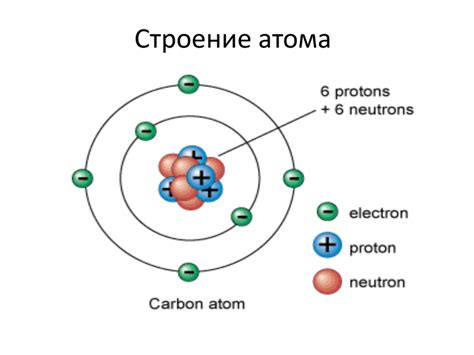
Атом состоит из ядра и электронной оболочки. Ядро содержит протоны и нейтроны, а электронная оболочка населена электронами.
Протоны - это положительно заряженные частицы, имеющие массу, равную примерно 1 атомной единицы. В ядре есть и нейтроны - частицы без заряда, но с массой, также равной примерно 1 атомной единице.
Электроны - это отрицательно заряженные частицы, обращающиеся вокруг ядра по определенным орбитам - электронным оболочкам. Количество электронов в атоме равно количеству протонов и определяется атомным номером элемента.
Электроны в атоме распределены по энергетическим уровням и подуровням. Внешний уровень электронов в атоме называется валентным уровнем. Число электронов на валентном уровне определяет химические свойства элемента.
В итоге, строение атома состоит из ядра, состоящего из протонов и нейтронов, и электронной оболочки, населенной электронами, которые обращаются по орбитам вокруг ядра.
Энергетические уровни и электроны
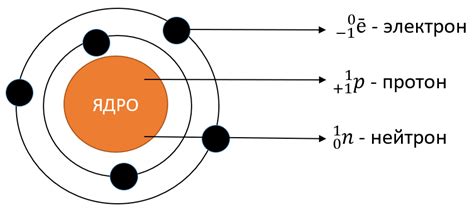
Первый энергетический уровень наименее энергетический, а последующие уровни имеют все более высокую энергию. На каждом энергетическом уровне может находиться определенное количество электронов.
Уровни энергии атома обозначаются буквами. Наиболее низкий энергетический уровень обозначается буквой K, следующий - L, затем M и так далее.
Каждый энергетический уровень может содержать определенное количество подуровней. Подуровни обозначаются буквами s, p, d, f в зависимости от количества орбиталей на данном подуровне.
На каждом энергетическом уровне подуровни заполняются электронами в соответствии с правилами заполнения электронных оболочек. Например, первый энергетический уровень (K) может содержать только один подуровень s, а каждый подуровень s может содержать максимум 2 электрона.
Энергетические уровни и предельное количество электронов на каждом уровне определяют электронную конфигурацию атома. Электронная конфигурация имеет важное значение при определении химических свойств элемента и его взаимодействия с другими атомами.
Основные характеристики внешнего уровня

У внешнего уровня электронной оболочки атома есть несколько основных характеристик, которые определяют его свойства и взаимодействие с другими атомами:
- Квантовое число главной энергетической оболочки (n): это число указывает на расстояние между внешним уровнем и ядром атома. Чем больше значение этого числа, тем дальше от ядра находится внешний электрон.
- Квантовое число магнитного момента (l): это число указывает на форму орбиты, на которой находится внешний электрон. В зависимости от значения этого числа орбита может быть сферической (l=0), плоской (l=1) или сложной (l>1).
- Квантовое число магнитной проекции (m): это число указывает на ориентацию орбиты в пространстве. Значение этого числа может быть от -l до +l, включая ноль.
- Магнетон Бора (μ): это величина, которая определяет магнитный момент электрона на внешнем уровне. Она равна примерно 9,274 × 10^-24 Дж/Тл.
Знание этих основных характеристик внешнего уровня электронной оболочки позволяет лучше понять структуру и свойства атомов, а также прогнозировать их взаимодействие с другими атомами и молекулами.
Взаимодействие электронов на внешнем уровне
Электроны на внешнем уровне могут вступать во взаимодействие друг с другом и с электронами других атомов. Это взаимодействие определяет ряд физических и химических свойств вещества, таких как проводимость, прозрачность и оптические свойства.
Взаимодействие электронов на внешнем уровне можно представить с помощью таблицы взаимных электростатических взаимодействий. В этой таблице приведены значения энергии взаимодействия между всеми парами электронов на внешнем уровне. Значение энергии взаимодействия зависит от удаленности электронов друг от друга и от их электрических зарядов.
| Электрон 1 | Электрон 2 | Энергия взаимодействия |
|---|---|---|
| Электрон 1 | Электрон 2 | Э1-2 |
| Электрон 1 | Электрон 3 | Э1-3 |
| Электрон 1 | Электрон 4 | Э1-4 |
| Электрон 2 | Электрон 3 | Э2-3 |
| Электрон 2 | Электрон 4 | Э2-4 |
| Электрон 3 | Электрон 4 | Э3-4 |
Энергия взаимодействия между электронами на внешнем уровне может быть как положительной, так и отрицательной. Положительное значение энергии говорит о притяжении электронов друг к другу, а отрицательное значение - о их отталкивании. Взаимодействие электронов на внешнем уровне напрямую влияет на свойства вещества и их химическую активность.