Энергия активации - один из ключевых параметров химических и физических процессов, играющих важную роль в различных областях науки и техники. Этот термин часто используется для описания барьера, который должен быть преодолен, чтобы начать химическую или физическую реакцию.
Энергия активации является энергией, которую необходимо передать реагирующим веществам, чтобы преодолеть репульсивные силы и активировать их для предстоящего взаимодействия. Она определяет скорость и вероятность протекания химической или физической реакции. Чем выше энергия активации, тем выше необходимое значение энергии для инициирования процесса.
Роль энергии активации заключается в том, что она определяет возможность и скорость химической реакции или процесса. Если энергия активации низка, то реакция может происходить достаточно быстро, так как реагирующие вещества могут сыграть роль "катализатора" в активации других молекул. Если энергия активации высока, то процесс может быть медленным или вообще не происходить без дополнительного внешнего воздействия.
Энергия активации имеет важное значение не только в химии, но и в других областях, таких как физика, биология и инженерное дело. Знание энергии активации помогает ученым и инженерам контролировать и оптимизировать процессы, разрабатывать новые материалы и технологии, исследовать катализ и многое другое. С пониманием этого понятия возможно улучшение энергоэффективности и экологической безопасности различных процессов и производств.
Энергия активации: основные моменты и значение

Одним из основных моментов, связанных с энергией активации, является то, что она зависит от характера взаимодействия между реагентами. Для реакций, протекающих с высокой скоростью, энергия активации обычно невелика. В случае более сложных реакций, требующих дополнительных шагов, энергия активации может быть более значительной. Также важно отметить, что энергия активации обратно пропорциональна скорости реакции - чем меньше энергии активации, тем быстрее протекает реакция.
Значение энергии активации заключается в том, что она определяет скорость химической реакции. Чем ниже энергия активации, тем быстрее реакция происходит. Знание энергии активации позволяет прогнозировать скорость реакции и исследовать механизмы химических процессов.
Также энергия активации имеет важное значение в промышленности. Повышение температуры позволяет снизить энергию активации и ускорить химические реакции, что может быть полезно в процессах, требующих высоких скоростей превращения веществ.
Что такое энергия активации?
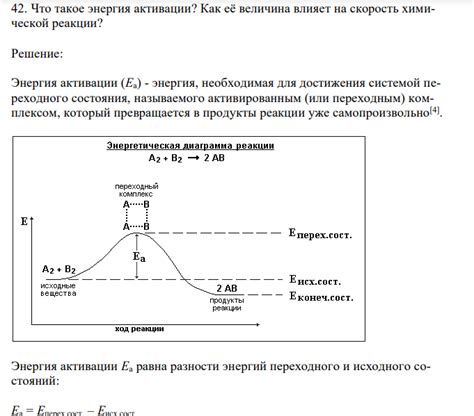
Каждая химическая реакция требует определенной активации, чтобы начаться. Без достаточной энергии активации реакция может замедлиться или остановиться полностью. Таким образом, энергия активации является важным показателем скорости химической реакции.
Энергия активации зависит от множества факторов, таких как температура, концентрация реагентов и наличие катализаторов. Повышение температуры увеличивает энергию частиц, что ускоряет химическую реакцию. Концентрация реагентов также оказывает влияние на энергию активации, поскольку большая концентрация увеличивает частоту столкновений молекул, что повышает вероятность преодоления энергетического барьера.
Катализаторы также снижают энергию активации, ускоряя химическую реакцию. Они участвуют в реакции, но не расходуются в процессе, поэтому они могут использоваться многократно.
Энергия активации играет важную роль в химических процессах, поскольку определяет скорость и возможность протекания реакции. Понимание понятия энергии активации позволяет контролировать и оптимизировать химические процессы для различных приложений, включая фармацевтику, пищевую промышленность и производство материалов.
Какова природа энергии активации?
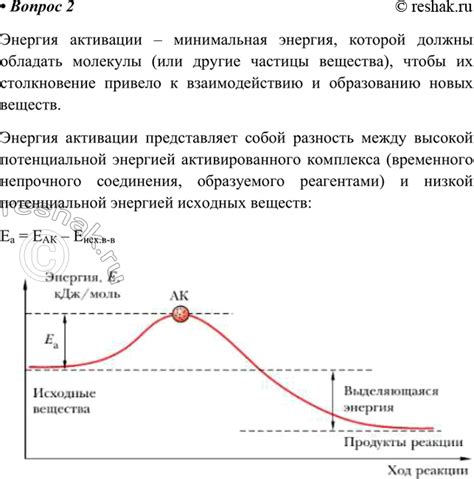
Природа энергии активации связана с идеей о потенциальной энергии, химических связях и кинетической энергии частиц. Во время реакции энергия активации подразумевает преодоление энергетического барьера, что возможно только при наличии достаточно высокой энергии частиц реагентов.
Энергетический барьер образуется из-за несовместимости энергетических состояний исходных реагентов и конечных продуктов. Реагенты должны приобрести достаточную энергию, чтобы преодолеть этот барьер и добраться до стабильного состояния конечных продуктов. Подобно подъему на гору, необходимо потратить энергию, чтобы достичь вершины и опуститься на другую сторону.
Энергия активации может быть представлена как энергетический барьер на энергетической поверхности реакции. Она зависит от различных факторов, таких как химические связи, конфигурация молекул и температура. Чем выше энергия активации, тем медленнее происходит реакция, так как потребуется больше энергии для преодоления барьера.
Однако, когда энергия активации достигает определенного уровня (называемого активационной энергией), значительно больше молекул реагентов обладают достаточной энергией для преодоления барьера. Это приводит к ускорению скорости реакции и образованию продуктов.
Понимание природы энергии активации позволяет ученым контролировать и оптимизировать химические реакции, основываясь на ее значении. Подбор оптимальных условий и катализаторов позволяет снизить энергию активации, ускорить химические процессы и повысить эффективность производства.
Каким образом энергия активации влияет на химическую реакцию?
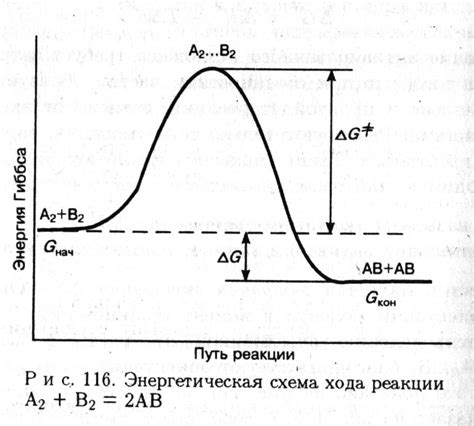
Энергия активации влияет на распределение энергии между реакционными частицами. В изолированной системе частицы могут обладать различной энергией, и только частицы с энергией, превышающей энергию активации, смогут преодолеть барьер и реагировать. Это означает, что чем выше энергия активации, тем меньше частиц смогут преодолеть ее, и, следовательно, меньше будет образовываться продуктов реакции.
Катализаторы играют важную роль в снижении энергии активации реакции. Они увеличивают скорость реакции, позволяя более большому количеству частиц преодолеть энергетический барьер. Катализаторы достигают этого путем предоставления альтернативного пути реакции с более низкой энергией активации. Таким образом, катализаторы ускоряют реакцию, но не изменяют начальные и конечные состояния реакционных частиц.
Одним из приложений энергии активации является определение стабильности химических соединений. Чем выше энергия активации реакции разложения, тем более стабильным является соединение. Это объясняет, почему некоторые соединения просто существуют, не подвергаясь химическому разложению при обычных условиях.
| Реакция | Энергия активации (кДж/моль) |
|---|---|
| Реакция A | 50 |
| Реакция B | 80 |
| Реакция C | 120 |
Как повысить энергию активации в реакции?
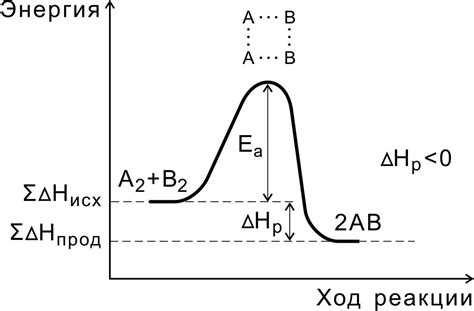
1. Повышение температуры:
Известно, что повышение температуры приводит к увеличению средней кинетической энергии молекул. Выброс энергии, необходимой для преодоления барьера активации, становится легче. Это позволяет реакции протекать быстрее.
2. Использование катализаторов:
Катализаторы - вещества, которые повышают скорость химической реакции, уменьшая энергию активации. Они обеспечивают альтернативный механизм реакции, который требует меньшей энергии для протекания.
3. Повышение концентрации реагентов:
Реакция будет протекать быстрее, если концентрация реагентов выше. Это происходит из-за большего количества частиц, способных вступить во взаимодействие. Более высокая концентрация увеличивает шансы реагентов на коллизии, которые смогут преодолеть барьер активации.
4. Использование фотохимической активации:
Некоторые реакции могут быть активированы светом. Фотохимическая активация основана на поглощении энергии света молекулами. При возбуждении энергетическим фотоном молекуле становится проще преодолеть барьер активации.
5. Использование электрического скачка:
Электрическое поле может использоваться для увеличения энергии активации реакции. Энергия, подведенная через электрическое поле, может увеличивать скорость движения молекул и способствовать преодолению барьера активации.
Использование этих методов может повысить энергию активации в реакции и способствовать более эффективному протеканию химических процессов. Каждый из этих подходов имеет свои особенности и может быть применим в различных ситуациях.
Как связана энергия активации с температурой?

При повышении температуры, молекулы движутся быстрее и их энергия кинетическая энергия возрастает. Это означает, что больше молекул имеют энергию, достаточную для преодоления энергии активации и участия в реакции.
Другими словами, при повышении температуры, энергия активации снижается. Это феномен известен как "термическое разрушение" или "захват молекулярными коллизиями".
Таблица ниже иллюстрирует влияние температуры на энергию активации и скорость реакции:
| Температура | Энергия активации | Скорость реакции |
|---|---|---|
| Низкая | Высокая | Медленная |
| Высокая | Низкая | Быстрая |
Из таблицы видно, что при повышении температуры энергия активации снижается, что приводит к увеличению скорости реакции. Это объясняет, почему многие химические реакции происходят быстрее при повышенной температуре.
Понимание связи между энергией активации и температурой имеет большое значение в химической кинетике и позволяет управлять скоростью химических реакций путем изменения температуры.
Как энергия активации связана с катализом?
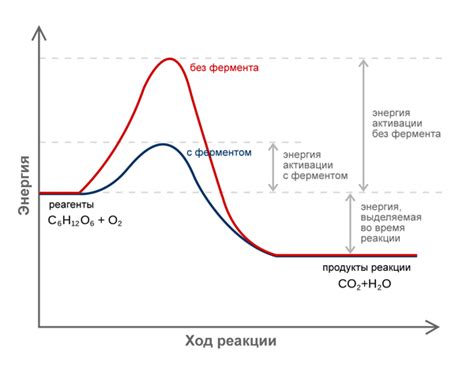
Катализаторы действуют, уменьшая энергию активации, необходимую для формирования переходного состояния, во время которого протекает реакция. Они обычно взаимодействуют с реагентами, образуя комплексы, которые стабилизируют переходное состояние и ускоряют протекание реакции. После завершения реакции катализатор возвращается к исходному состоянию и может использоваться снова.
Использование катализаторов позволяет улучшить кинетику химических реакций, что имеет большое значение для промышленных процессов и производства. Катализаторы могут быть различными по своей природе - металлическими, органическими или биологическими веществами.
Таким образом, катализаторы играют важную роль в снижении энергии активации реакций, что позволяет ускорить их протекание. Это экономически эффективный подход, который находит широкое применение в различных областях науки и промышленности.
Какая роль энергии активации в биологических системах?
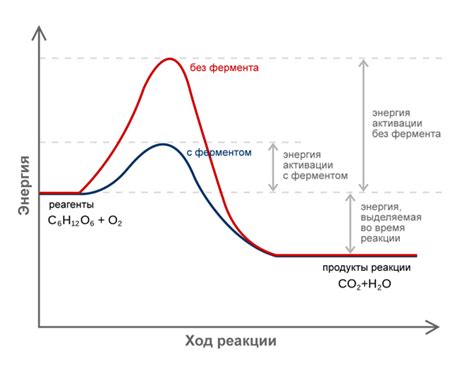
Энергия активации играет важную роль в биологических системах, так как она определяет скорость химических реакций в организмах. Биологические реакции, такие как метаболизм, дыхание и синтез белка, требуют определенной энергии для их осуществления. Во время этих реакций происходят связывание и разрывание химических связей, что требует энергии.
Энергия активации представляет собой энергию, необходимую для преодоления энергетического барьера и инициирования реакции. В биологических системах, энергию активации можно сравнить с энергией, необходимой для запуска двигателя. Без нее, реакция не начнется даже при наличии достаточного количества реагентов.
В биологических системах, энергия активации может быть увеличена или снижена различными факторами. Например, ферменты, которые являются белками, участвуют в химических реакциях в организмах. Ферменты понижают энергию активации, ускоряя реакцию и делая ее более эффективной. Они достигают этого путем создания так называемого активного центра, который стимулирует связывание реагентов и ускоряет образование продуктов.
Энергия активации также может быть изменена изменением температуры. Повышение температуры обычно увеличивает энергию частиц, что способствует более частым столкновениям и ускорению реакций. Однако, слишком высокая температура может оказывать негативное воздействие на биологические системы, так как они могут быть чувствительны к изменениям окружающей среды.
| Роль энергии активации в биологических системах: |
|---|
| 1. Регулирование скорости химических реакций в организмах. |
| 2. Повышение эффективности реакций путем понижения энергии активации. |
| 3. Ускорение реакций с помощью ферментов и активных центров. |
| 4. Изменение энергии активации через изменение температуры. |
Таким образом, энергия активации играет фундаментальную роль в биологических системах, обеспечивая правильное функционирование и регулирование химических реакций организмов.
Как энергия активации влияет на скорость химических процессов?

Скорость химической реакции определяется количеством взаимодействующих частиц, их энергией и вероятностью столкновения. Чем выше энергия активации, тем меньше количество молекул, обладающих достаточной энергией для преодоления барьера, и тем медленнее будет протекать реакция.
При низкой энергии активации молекулы могут преодолевать барьер легче и быстрее, в результате чего реакция протекает быстрее. Напротив, высокая энергия активации затрудняет протекание реакции, поскольку меньшее количество молекул способно достичь необходимой энергии для реакции.
Изменение энергии активации может происходить под воздействием различных факторов, таких как температура, концентрация реагентов и наличие катализаторов. Повышение температуры увеличивает энергию молекул, что увеличивает вероятность преодоления барьера и ускоряет реакцию.
| Фактор | Влияние на энергию активации | Влияние на скорость реакции |
|---|---|---|
| Температура | Увеличивает энергию молекул | Ускоряет реакцию |
| Концентрация реагентов | Увеличивает количество молекул, способных столкнуться | Ускоряет реакцию |
| Наличие катализаторов | Понижает энергию активации | Ускоряет реакцию |
Таким образом, энергия активации играет ключевую роль в определении скорости химических процессов. Понимание и контроль этого параметра позволяет ускорять или замедлять реакции в различных химических системах.