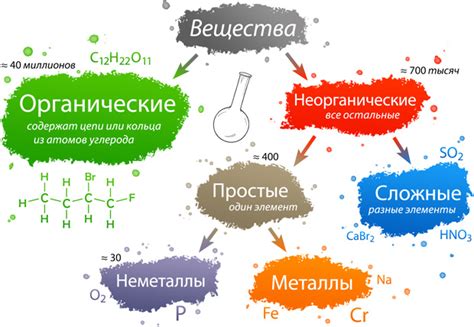
Химическое вещество - это совокупность атомов, ионов или молекул, которые характеризуются определенными свойствами и обладают определенным составом. Для понимания химических реакций и взаимодействий веществ необходимо разобраться в их структуре и основных компонентах.
Вещество состоит из атомов, которые являются основными строительными блоками. Атом состоит из ядра, которое содержит протоны и нейтроны, а также облака электронов, которые находятся на определенных энергетических уровнях. Протоны имеют положительный заряд, нейтроны являются нейтральными, а электроны обладают отрицательным зарядом.
Атомы соединяются между собой, образуя молекулы. Молекула - это минимальная единица вещества, которая сохраняет его химические и физические свойства. Вещество может быть представлено как одноатомное (например, инертные газы), так и многоатомное (например, вода или сахар). Молекулы могут быть составлены из атомов одного элемента или из атомов разных элементов.
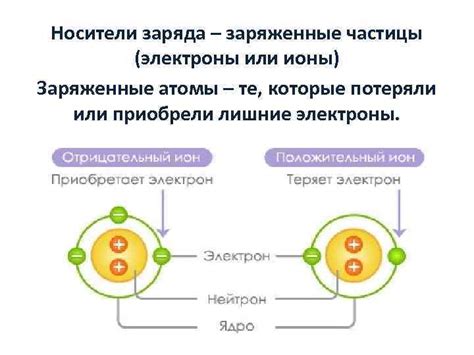
Другим важным компонентом вещества являются ионы. Ионы - это электрически заряженные атомы или группы атомов. Они образуются при потере или приобретении атомом электронов. Положительно заряженные ионы называются катионами, а отрицательно заряженные - анионами.
Понимание структуры вещества и его компонентов является фундаментальным для изучения химии. Это позволяет понять основные принципы химических реакций, свойства веществ и их взаимодействия. Углубленное изучение структуры вещества позволяет разрабатывать новые материалы, лекарства и технологии, что вносит значительный вклад в развитие науки и промышленности.
Основные компоненты структуры вещества в химии
Ядро атома содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Количество протонов определяет элементарный состав вещества и называется атомным номером. Нейтроны же влияют на массовое число атома.
Вокруг ядра атома находятся электроны, которые находятся в электронных оболочках. Электроны имеют отрицательный заряд и определяют химические свойства вещества. Количество электронов в оболочках определяет электронную конфигурацию атома и его химическую активность.
Основные компоненты структуры вещества включают также связи между атомами. Атомы образуют связи, чтобы достигнуть более стабильной конфигурации. Они могут образовывать различные типы связей, такие как ионные, ковалентные и металлические связи.
Связи в органических соединениях также могут включать атомы кислорода, азота, серы и других элементов. Подобные связи определяют химические свойства органических молекул и их реакционную способность.
В целом, структура вещества в химии является ключевым фактором в понимании и объяснении химических свойств и реакций вещества. Понимание основных компонентов структуры вещества позволяет углубленно изучать химию и применять полученные знания в различных областях науки и технологий.
Атомы: строительный блок всех веществ

Протоны - положительно заряженные частицы, находящиеся в ядре атома. Они имеют массу, равную примерно 1 атомной единице и определяют химический элемент. Количество протонов в атоме называется атомным номером и определяет его положение в таблице химических элементов.
Нейтроны - нейтральные по заряду частицы, также находящиеся в ядре атома. Они имеют массу, схожую с массой протонов, и не влияют на химические свойства атома. Нейтроны выполняют роль "клея", удерживающего протоны вместе в ядре атома.
Электроны - отрицательно заряженные частицы, движущиеся по определенным орбитам вокруг ядра атома. Они имеют очень маленькую массу по сравнению с протонами и нейтронами, но имеют ключевое значение в химии, так как определяют химические свойства атома и его взаимодействия с другими атомами.
Атомы могут объединяться в молекулы путем химических связей, образуя все виды веществ - от простых молекул до сложных полимеров. Изучение структуры атомов и способов их взаимодействия позволяет химикам и физикам понимать основы физических и химических процессов, происходящих вокруг нас.
Молекулы: связанные атомы, образующие химические соединения

Связь между атомами в молекуле может быть ковалентной или ионной. Ковалентная связь формируется, когда атомы делят пару электронов между собой, образуя общую электронную оболочку. Ионная же связь возникает при передаче одного или нескольких электронов от одного атома к другому, образуя положительный и отрицательный ионы.
Молекулы, состоящие из двух одинаковых атомов, называются простыми или диатомическими. Например, кислород встречается в природе в виде молекул O2 - двух атомов кислорода, соединенных ковалентной связью.
Молекулы также могут состоять из различных атомов, образуя сложные или многоатомные молекулы. В таких молекулах атомы могут быть связаны как ковалентными, так и ионными связями. Примером многоатомной молекулы является вода (H2O), состоящая из двух атомов водорода и одного атома кислорода, связанных ковалентными связями.
Соединения различных химических элементов могут образовывать огромное количество различных молекул. Это позволяет химикам создавать новые вещества с разнообразными свойствами и применениями. Молекулы являются основными строительными блоками веществ и определяют их свойства, включая физические и химические.
Химические связи: силы, удерживающие атомы в молекуле

В мире химии атомы объединяются в молекулы благодаря химическим связям. Химические связи представляют собой силы, которые удерживают атомы в молекуле. Они определяют устройство и свойства вещества.
Существует несколько типов химических связей, включая ионные связи, ковалентные связи и металлические связи.
Ионные связи возникают между атомами, которые имеют разные электрические заряды. Одни атомы отдают электроны, становясь положительно заряженными ионами (катионами), а другие атомы принимают эти электроны, становясь отрицательно заряженными ионами (анионами). Эти противоположные заряды притягиваются, образуя ионные связи.
Ковалентные связи возникают, когда атомы делят электроны между собой. В результате образуется общая область электронной плотности, которая удерживает атомы вместе. Ковалентные связи характерны для молекул органических веществ, таких как углеродные соединения.
Металлические связи характерны для металлических элементов. В этом случае свободные электроны перемещаются по всей структуре металла, создавая силу притяжения, которая удерживает атомы вместе. Благодаря этому свойству металлы обладают высокой теплопроводностью и электропроводностью.
Каждый тип химической связи обладает своими уникальными свойствами и определяет характер вещества. Благодаря химическим связям возможно образование сложных структур и молекул, что позволяет многообразные соединения на основе одних и тех же элементов.
Электроны: основные носители электрического заряда
Электрический заряд электрона имеет фиксированное значение и равен противоположному по величине заряду протона, элементарной положительно заряженной частицы. Таким образом, электрон и протон являются противоположными по знаку и равными по величине зарядами.
Электроны играют важную роль в химических реакциях и процессах, связанных с передачей электрического заряда. Они являются основными носителями электрического тока в проводниках и полупроводниках. Электроны также отвечают за свойства веществ, такие как проводимость, радиоактивность, магнитные свойства и др.
Положение электронов в атоме и их взаимодействие определяют химические свойства вещества. Электроны в электронных оболочках атома расположены в энергетических уровнях, которые различаются по энергии. При взаимодействии атомов между собой электроны могут переходить с одного энергетического уровня на другой, что приводит к образованию химических связей и обмену электрическим зарядом.
Таким образом, электроны являются основными компонентами структуры вещества и играют ключевую роль в химических процессах и явлениях связанных с электрическими свойствами вещества.
Протоны: положительно заряженные частицы в ядре атома

Протоны обладают массой, которая превышает массу электрона в ~1836 раз. Таким образом, они являются наиболее массивными частицами в атоме. Массовое число атома определяется суммой протонов и нейтронов в ядре.
Взаимодействие протонов между собой и с другими заряженными частицами, такими как электроны, определяет свойства вещества и его химическую реактивность. Протоны играют важную роль в явлениях, связанных с электромагнитным взаимодействием и образованием химических связей.
Протоны также являются ключевыми элементами в ядерных реакциях. При делении атомного ядра протоны могут испытывать различные изменения, включая изменение количества протонов в результате распада ядра.
Наличие протонов в ядре определенного элемента является базовым свойством этого элемента и определяет его положение в периодической системе элементов. Например, водород состоит только из одного протона, а углерод имеет шесть протонов в своем ядре.
Нейтроны: нейтральные частицы в ядре атома

Нейтроны не взаимодействуют с электромагнитным полем, поэтому они не участвуют в химических реакциях и не влияют на заряд атома. Тем не менее, нейтроны играют важную роль в ядре атома. Они обеспечивают стабильность ядра и снижают электростатическое отталкивание между протонами.
Количество нейтронов в ядре определяет изотоп атома. Изотопы элементов имеют одинаковое количество протонов, но различное количество нейтронов. Это приводит к различным массам и свойствам атомов одного и того же элемента. Например, углерод может существовать в трех изотопических формах с 6, 7 и 8 нейтронами в ядре.
Сумма протонов и нейтронов в ядре определяет ядерную массу атома. Массовое число элемента равно сумме протонов и нейтронов. Нейтроны играют важную роль в ядерных реакциях, таких как деление и слияние ядер, которые являются основой ядерной энергии и атомной бомбы.
Элементы: различные типы атомов, классифицирующиеся по атомному номеру

По атомному номеру элементы делятся на различные типы:
- Первая группа: элементы с атомным номером от 1 до 2. В эту группу входят водород и гелий.
- Вторая группа: элементы с атомным номером от 3 до 10. Сюда входят литий, бериллий, бор, углерод, азот, кислород, фтор, неон.
- Третья группа: элементы с атомным номером от 11 до 18. В эту группу входят натрий, магний, алюминий, кремний, фосфор, сера, хлор, аргон.
- ...
Существует 118 различных элементов, отсортированных по атомному номеру от 1 до 118. Каждый элемент обладает уникальными свойствами, определяющими его место в периодической таблице и его возможное взаимодействие со другими элементами.
Изучение элементов и их атомных свойств позволяет ученым углубить понимание структуры вещества и применить это знание для создания новых материалов, лекарственных препаратов и много других промышленных продуктов.
Ионная составляющая: атомы, лишенные или имеющие избыточную электронную структуру

Ионная составляющая вещества в химии представляет собой атомы, которые либо лишены, либо имеют избыточное количество электронов в своей электронной оболочке. Эти атомы способны образовывать ионы и обладают определенными электрохимическими свойствами.
Атомы, лишенные электрона, называются катионами. У них есть положительный заряд, так как количество положительных протонов в ядре превышает количество отрицательных электронов. Катионы могут притягивать к себе отрицательно заряженные частицы и образовывать ионные связи с атомами, имеющими избыточное количество электронов.
Атомы, имеющие избыточную электронную структуру, называются анионами. У них есть отрицательный заряд, так как количество отрицательных электронов превышает количество положительных протонов в ядре. Анионы могут быть притянуты к катионам и образовывать ионные связи, образуя таким образом структуру ионных кристаллов.
Ионная составляющая вещества играет важную роль в химических реакциях и процессах. Ионные соединения обладают определенными свойствами, такими как хорошая проводимость электрического тока в растворах, высокая температура плавления и кипения и т.д. Они также широко используются в различных областях, включая промышленность, медицину и сельское хозяйство.