Атом является основной структурной единицей вещества, и его исследование является одной из важнейших задач в физике и химии. Атом состоит из ядра и электронной оболочки. Ядро представляет собой центральную часть атома, в которой сосредоточена большая часть массы, и оно содержит протоны и нейтроны. Электронная оболочка состоит из электронов, которые обращаются по орбитам вокруг ядра.
Протоны – это положительно заряженные элементарные частицы, имеющие массу, равную массе нейтрона. Протоны нумеруются порядковыми числами и определяют химический элемент. Число протонов в ядре атома называется атомным номером и обозначается буквой Z. Нейтроны не имеют электрического заряда, но также имеют массу. Ядро атома характеризуется числом нейтронов, которое обозначается буквой N.
Существуют также другие элементарные частицы, такие как электроны и электроны, которые являются фундаментальными строительными блоками материи. Электроны имеют отрицательный электрический заряд и несут наименьшую единичную отрицательную зарядовую единицу – элементарный заряд. Электроны находятся внутри электронных оболочек. Нейтрино – это элементарные нейтральные частицы, которые практически не взаимодействуют с веществом.
Состав атома: структура и состав ядра
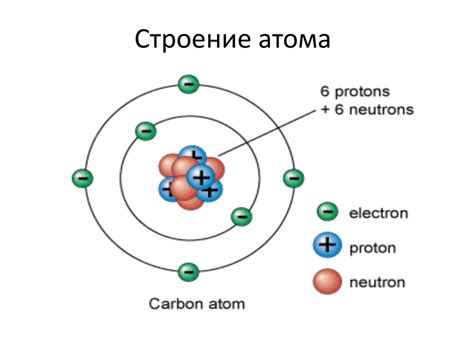
Атом, основная единица вещества, состоит из ядра и облака электронов, которые обращаются на определенных орбитах вокруг ядра.
Ядро атома представляет собой маленькую и плотно упакованную структуру, содержащую протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Вместе они образуют ядро атома, определяя его химические и физические свойства.
Число протонов в ядре называется атомным номером и определяет химический элемент. Например, у атома водорода только один протон, а у атома железа их 26. Нейтроны, в свою очередь, помогают ядру оставаться стабильным и уравновешенным.
Совокупность протонов и нейтронов в ядре определяет его массовое число. Масса протона и нейтрона примерно одинакова и составляет около 1 атомной единицы массы (аму). Массовое число атома равно сумме числа протонов и числа нейтронов в ядре.
Таким образом, структура ядра атома играет важную роль в определении его химических свойств и взаимодействия с другими атомами. Изменение числа протонов и нейтронов в ядре может привести к образованию разных изотопов одного элемента, которые имеют разные массовые числа, но сохраняют тот же атомный номер.
Атом: определение и принципы

Ядро атома состоит из протонов и нейтронов, которые вместе называются нуклонами. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Количество протонов в ядре определяет химические свойства элемента и называется атомным номером. Протоны и нейтроны сильно связаны и взаимодействуют силой ядра. Вместе они формируют большую часть массы атома.
Электроны располагаются на энергетических уровнях вокруг ядра. Они имеют отрицательный заряд и поддерживают электростатическое равновесие с положительно заряженными протонами. Количество электронов в атоме равно количеству протонов и определяет его электрическую нейтральность. Электроны находятся в постоянном движении и образуют облако электронной плотности, которое определяет размер атома.
Принципы, описывающие поведение атомов, основаны на квантовой механике. Эта наука объясняет, что энергия электронов в атоме дискретна и фиксирована. Электроны могут переходить между энергетическими уровнями путем поглощения или испускания квант энергии. Это явление называется квантовым скачком и объясняет процессы, связанные с поглощением и испусканием света, например при взаимодействии атомов с электромагнитным излучением.
Исследование структуры атома и его элементарных частиц позволяет лучше понять фундаментальные законы природы, химические свойства вещества и применять их в различных областях науки и технологии.
Элементарные частицы: разновидности и роль
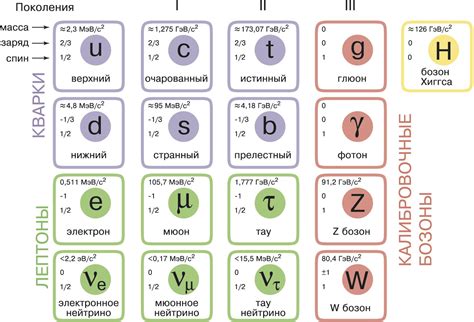
Кварки - это также фундаментальные частицы, но они составляют состояния стабильности только в сочетании друг с другом. Кварки могут быть нейтральными, положительными или отрицательными по заряду. Есть шесть различных видов кварков: верхний, нижний, странный, вверх, вниз и очаровательный. Кроме того, существуют античастицы для каждого кварка, с противоположным зарядом.
Роль элементарных частиц в атоме заключается в формировании ядра. Протоны и нейтроны являются барионами и состоят из сочетания кварков. Протоны состоят из двух верхних кварков и одного нижнего кварка, а нейтроны содержат один верхний кварк и два нижних кварка. Вместе они обеспечивают ядру атома стабильность и заряд.
Таким образом, элементарные частицы являются основными строительными блоками атомов и ядер. Исследование и понимание их свойств и взаимодействий важно для понимания физических законов, обуславливающих состав и поведение материи во Вселенной.
Ядро атома: состав и свойства
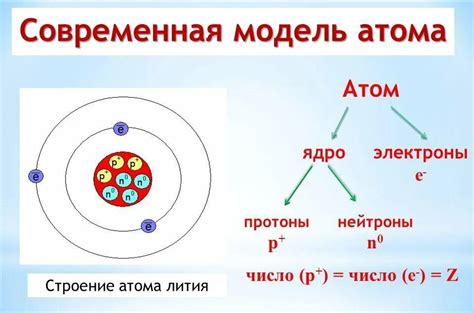
Состав ядра. Протоны и нейтроны. Ядро атома состоит из протонов и нейтронов. Протоны имеют положительный электрический заряд, а нейтроны не имеют заряда. Общее количество протонов в ядре определяет атомный номер элемента и обозначается символом Z. Нейтроны не влияют на атомный номер и обозначаются символом N.
Массовое число. Массовое число ядра, обозначаемое символом A, определяется суммой протонов и нейтронов. Отношение протонов к нейтронам может быть разным для разных элементов, и это отношение влияет на свойства ядра.
Свойства ядра. Ядро атома обладает несколькими важными свойствами:
- Масса ядра. Масса ядра определяется суммой масс протонов и нейтронов. Она является основным фактором в определении массы атома и его химических свойств.
- Плотность ядра. Ядро атома очень компактное и плотное. Несмотря на свои малые размеры, оно содержит значительное количество материи и концентрирует большую часть массы атома.
- Заряд ядра. Ядро атома содержит положительный электрический заряд, так как оно состоит из протонов. Это положительное зарядное ядро притягивает электроны и образует электростатическую силу притяжения, которая поддерживает электроны вокруг ядра.
- Связывающая энергия. Ядро атома обладает связующей энергией, которая удерживает протоны и нейтроны вместе. Эта энергия возникает из сильного ядерного взаимодействия и стабилизирует ядро, предотвращая его распад.
Ядра атомов разных элементов могут иметь разное количество протонов и нейтронов, что приводит к различным свойствам элементов и их изотопов. Изучение ядерных свойств является важной областью науки, ведь это позволяет понять происхождение и эволюцию элементов во Вселенной.
Электроны: расположение и функции
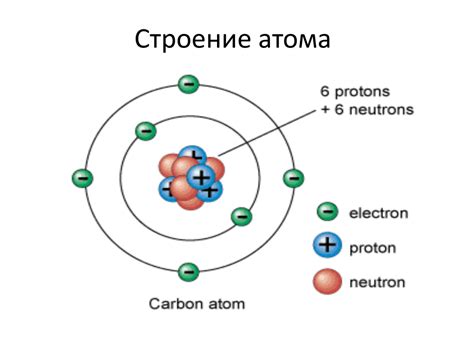
Электроны в атоме распределены по энергетическим уровням, которые называются электронными оболочками. Первая электронная оболочка находится ближе всего к ядру и имеет наименьшую энергию. Вторая оболочка находится на большем расстоянии и имеет более высокую энергию, а третья оболочка находится еще дальше и имеет еще большую энергию, и так далее.
Каждая электронная оболочка состоит из подуровней, которые обозначаются буквами s, p, d, f. Каждый подуровень может вмещать определенное количество электронов: s-подуровень - 2 электрона, p-подуровень - 6 электронов, d-подуровень - 10 электронов, f-подуровень - 14 электронов.
Функции электронов в атоме очень важны. Они участвуют в химических реакциях, образуя химические связи между атомами, обеспечивая стабильность молекул. Электроны также обладают спином, что позволяет им формировать магнитные свойства вещества.
Расположение и движение электронов в атоме могут быть представлены различными моделями, такими как модель Бора или модель облачка электронов. В этих моделях электроны описываются как частицы, движущиеся по определенным орбитам или радиусам.
Связь между частицами: силы и их взаимодействие
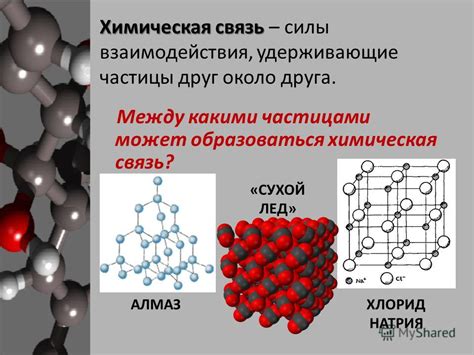
Одной из основных сил, определяющих взаимодействие между частицами, является электромагнитная сила. Эта сила проявляется при взаимодействии заряженных частиц. Заряженные частицы притягиваются или отталкиваются друг от друга в зависимости от знака и величины их заряда. Электромагнитная сила играет важную роль в связи между электронами и ядром атома, а также во взаимодействии атомов и молекул.
Кроме электромагнитной силы, существуют другие силы, которые влияют на взаимодействие между частицами. Например, сильное взаимодействие – это сила, действующая между кварками, элементарными частицами, составляющими протоны и нейтроны в ядре атома. Сильное взаимодействие обладает огромной силой, но действует только на крайне малых расстояниях.
Также существуют слабое взаимодействие и гравитационная сила. Слабое взаимодействие отвечает за некоторые типы радиоактивного распада и другие процессы внутри атомов. Гравитационная сила, в свою очередь, является наиболее слабой из всех известных сил и действует между всеми частицами, имеющими массу, в том числе между атомами и ядрами.
| Сила | Описание | Примеры проявления |
|---|---|---|
| Электромагнитная | Взаимодействие между заряженными частицами | Притяжение и отталкивание зарядов |
| Сильное взаимодействие | Взаимодействие между кварками | Составление протонов и нейтронов |
| Слабое взаимодействие | Отвечает за радиоактивный распад | Процессы внутри атомов |
| Гравитационная | Взаимодействие между частицами с массой | Притяжение между атомами и ядрами |
Все эти силы взаимодействия между частицами играют важную роль в мире атомов и ядер. Благодаря ним мы можем понимать и объяснять различные физические явления и свойства вещества.