Когда речь заходит о химических соединениях, часто обсуждается их структура и прочность связей. В этой статье мы рассмотрим сравнение прочности П связей и сигма связей, двух самых распространенных типов химических связей. П связи и сигма связи имеют свои отличительные особенности и свойства, которые мы исследуем далее.
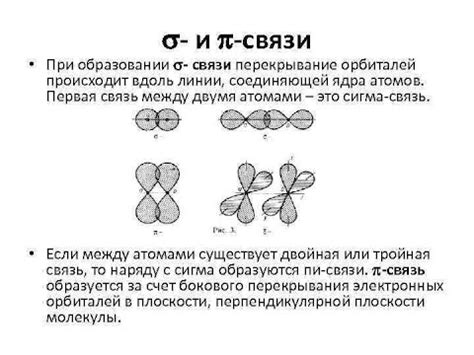
Сигма связь - это химическая связь, в которой атомы соединены прямым перекрестным наложением своих орбиталей. Она состоит из одной парной и одной непарной орбитали, образуя общую область высокой электронной плотности между атомами. Сигма связь является самой сильной и наиболее стабильной формой химической связи, что делает ее основной составляющей всех молекул.
П связь, или пи-связь, представляет собой более слабую и менее устойчивую форму связи. Она образуется при перекрестном наложении пи-орбиталей, которые являются несимметричными и имеют области высокой электронной плотности над и под плоскостью между атомами. П связи обычно присутствуют в молекулах, содержащих двойные или тройные связи, и имеют более высокую энергию, чем сигма связи.
Прочность П связей и сигма связей: основные отличия
Прочность П связей заключается в их способности существовать в различных формах, таких как сопряженные и ароматические системы. Эти связи могут образовываться между различными атомами, такими как углерод, азот и кислород. Они обладают сравнительно низкой энергией и часто играют важную роль в реакциях, проводимых в органической химии.
С другой стороны, сигма связи являются более прямыми и простыми формами химических связей, которые образуются при перекрестном наложении орбиталей двух атомов. Отличительной особенностью сигма связей является их симметричная форма и большая сила взаимодействия между атомами.
| Прочность П связей | Сигма связи |
|---|---|
| Образуются в сопряженных и ароматических системах | Образуются при перекрестном наложении орбиталей |
| Низкая энергия | Более сильные и стабильные |
| Играют важную роль в органической химии | Присутствуют во многих химических соединениях |
Таким образом, хотя обе связи являются важными для понимания химических взаимодействий, прочность П связей и сигма связей имеют некоторые отличия в своей структуре, энергии и функциональной роли. Понимание этих отличий поможет углубить наши знания о химической связи и ее роли в молекулярных системах.
Различия молекулярной структуры
| Тип связи | Молекулярная структура | Прочность связи |
|---|---|---|
| П связь | Образуется при перекрывании орбиталей p-симметрии двух атомов | Обычно более слабая и длиннее сигма связи |
| Сигма связь | Образуется при перекрывании орбиталей, имеющих сферическую симметрию | Обычно более прочная и короткая, чем П связь |
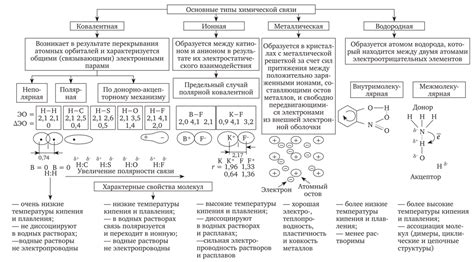
Молекулярная структура каждой связи определяется электронной конфигурацией атомов, а также геометрией расположения этих атомов в пространстве. Прочность связи зависит от электронной плотности и взаимодействия электронов, а также от энергии образуемых при этом взаимодействий.
Таким образом, молекулярная структура значительно влияет на прочность связей в молекулах. Сравнение П и сигма связей позволяет получить представление о различной химической активности этих связей и их поведении в различных химических реакциях.
Влияние типа атомов на стойкость связи
П связь – это две параллельные площадки электронной оболочки двух атомов, образующие перекрестный план с большей концентрацией плотности электронной оболочки. Такая связь обладает большей прочностью и стойкостью, поскольку электроны в ней распределены равномерно и находятся ближе к ядру.
Сигма связь – это взаимодействие между s-орбиталями атомов, которые перекрываются, образуя область с наибольшей электронной плотностью вдоль оси связи. В отличие от П связи, сигма связь имеет более слабую структуру из-за наличия дополнительных узлов в орбитали связывающих атомов.
Таким образом, тип атомов, образующих связь, имеет существенное влияние на ее прочность и стойкость. П связь обычно является более прочной, чем сигма связь. Это связано с особенностями электронной оболочки и распределением электронной плотности в молекуле.
Прочность П связей и сигма связей: химические свойства
П связь - это пи-связь, которая возникает между атомами, имеющими несвязанную пару электронов или электронное облако, обычно на атомах углерода, азота или кислорода. П связи характеризуются более слабой прочностью и более высокой энергией, чем сигма связи.
Сигма связь - это обычная одинарная, двойная или тройная связь, которая образуется между атомами при обмене электронами через перекрытие орбиталей. Сигма связи являются более сильными и более стабильными, чем П связи.
Особенностью П связей является то, что они могут быть дезактивированы влиянием соседних групп или атомов. При этом электроны дезактивируемой П связи могут передвигаться в плоскости молекулы. С другой стороны, сигма связи являются более устойчивыми к внешним воздействиям и труднее дезактивируются.
Химические свойства П связей и сигма связей напрямую зависят от их прочности. П связи обладают низкой прочностью и могут быть разрушены при воздействии тепла или химических реагентов. Сигма связи, наоборот, обладают высокой прочностью и обычно не разрушаются при нормальных условиях.
Прочность П связей и сигма связей также влияет на их реакционную активность. П связи, благодаря своей высокой энергии, могут быть активированы для участия в различных реакциях. Сигма связи, с другой стороны, обычно являются менее активными и участвуют в реакциях с меньшей энергией.
Таким образом, химические свойства П связей и сигма связей определяются их прочностью и энергией. П связи образуются между атомами с несвязанными парами электронов и обладают более высокой энергией и нижней прочностью. Сигма связи, в свою очередь, образуются при обмене электронами и обладают высокой прочностью и стабильностью.
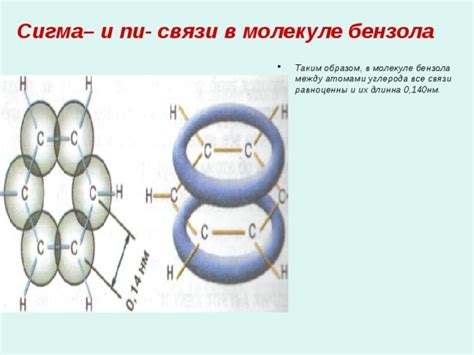
Образование П связей в органических соединениях
Образование П связей происходит путем попарного наложения электронных облаков соседних атомов углерода. Каждая П связь содержит два электрона, которые распределены в пространстве над и под плоскостью, проходящей через ядра связанных атомов. Это создает плоскую или плоско-параллельную структуру, что делает П связи намного прочнее, чем сигма связи.
Образование П связей возможно в молекулах, содержащих пилообразные или плоские атомы углерода, такие как алкены (с двойной П связью) и алкины (с тройной П связью). При этом, необходимо посредством химической реакции переносить электроны и налагать их облака для формирования П связей.
П связи обладают рядом интересных свойств, которые делают их важными для различных химических процессов. Они могут участвовать в реакциях, происходящих на двигающейся электронной оболочке, обеспечивая такие процессы, как попеременное наложение и удаление электронов, а также сопряженность атомов в молекуле, что влияет на ее физические и химические свойства.
Образование П связей является важным процессом в органической химии. Он позволяет создавать различные виды органических соединений, от ароматических соединений до полимеров. Благодаря П связям возможно образование сложных молекул, что дает возможность для создания разнообразных химических соединений, имеющих уникальные свойства и применения во многих сферах науки и технологии.
Особенности формирования сигма связей

Сигма связи образуются при перекрытии s- или p-орбиталей. Перекрытие орбиталей происходит по осям, проходящим через ядра атомов. Это приводит к симметричному распределению электронной плотности в пространстве между двумя атомами и созданию электростатического притяжения между ними.
Основные особенности формирования сигма связей:
- Сигма связи могут образовываться только между атомами с различными электронными орбиталями, такие как s и p-орбитали.
- Перекрытие орбиталей может быть линейным или нелинейным, в зависимости от геометрии молекулы.
- Сигма связи более стабильны и прочны, чем pi связи, так как плотность электронов в сигма связи концентрируется вдоль оси связи.
- Сигма связи более энергетически выгодны, поэтому в большинстве случаев предпочтительнее образуются сигма связи, а затем pi связи.
Формирование сигма связей является основой для построения более сложных молекул, таких как органические соединения. Они обеспечивают стабильность молекулярной структуры и определяют ее химические и физические свойства.
Прочность П связей и сигма связей: физические свойства
П связи, также известные как множественные связи, характеризуются наличием двух или более электронных пар, которые образуют более сильные связи между атомами. Эти связи могут быть двойными (одна σ связь и одна π связь) или тройными (одна σ связь и две π связи). Прочность П связей обусловлена наличием дополнительных π связей, которые обеспечивают дополнительные электронные взаимодействия.
Сигма (σ) связи представляют собой простые одиночные связи, которые образуются из-за перекрытия электронных орбиталей атомов. Они характеризуются высокой прочностью и устойчивостью. Прочность σ связей обусловлена полным перекрытием орбиталей и сильным электронным взаимодействием между атомами.
Таким образом, прочность П связей зависит от наличия π связей, которые обеспечивают дополнительные электронные взаимодействия, в то время как сигма связи обладают высокой прочностью за счет полного перекрытия орбиталей и сильного электронного взаимодействия.
Понимание физических свойств прочности П связей и сигма связей является важным для изучения химических соединений и их реакций, а также для разработки новых материалов и промышленных процессов.
Валентная связь и энергия активации
Кроме этого, валентная связь также включает в себя энергию активации, которая является минимальной энергией, необходимой для начала химической реакции. Для образования или разрыва валентных связей необходимо преодолеть эту энергию активации.
Точная величина энергии активации зависит от типа химической реакции и конкретных молекул, участвующих в реакции. Она может быть определена как разность энергии между начальным и конечным состояниями системы.
Выбор между П-связью и сигма-связью зависит от типа атомов, их гибридизации и реакционных условий. Валентная связь может быть одиночной, двойной или тройной, в зависимости от количества электронных пар, общих между атомами.
Энергия активации также имеет большое значение для понимания кинетических аспектов химических реакций. Чем выше энергия активации, тем медленнее протекает реакция, так как больше энергии нужно для преодоления барьера активации.
Таким образом, валентная связь и энергия активации играют важную роль в реакционной способности молекул и реакционной кинетике. Изучение этих аспектов позволяет получить более глубокое понимание химических реакций и их механизмов.