Аммиак (NH3) - важное соединение, широко используемое в промышленности и лабораторных условиях. Определение его массы в химических реакциях является ключевым шагом для понимания и изучения процессов, которые происходят внутри системы.
Существует несколько способов определения массы аммиака в химических реакциях. Один из них - использование уравнений реакций, провода различные эксперименты или расчеты. Еще один способ - использование химического анализа, такого как титрование или спектрофотометрия, для определения концентрации аммиака в реакционной смеси.
В этом полном руководстве для новичков представлены различные методы и подходы к определению массы аммиака в химических реакциях. Описаны методы, требующие применения химических экспериментов, и методы, основанные на численных расчетах и математических моделях. Вся информация представлена в доступной и понятной форме, чтобы помочь начинающим химикам разобраться в этой сложной и важной теме.
Определение массы аммиака

Если вам потребуется определить массу аммиака в химической реакции, следуйте нижеприведенным шагам:
- Определите химическое уравнение реакции, в которой участвует аммиак. Уравнение должно быть сбалансированным.
- Выразите уравнение в мольных пропорциях, чтобы узнать соотношение аммиака к другим веществам в реакции.
- Используя данные о молярных массах, найдите количество молей аммиака исходя из массы других веществ. Обычно это делается путем пропорционального расчета.
- Умножьте количество молей аммиака на его молярную массу, чтобы определить массу аммиака в граммах.
| Шаг | Описание |
|---|---|
| 1 | Определите химическое уравнение реакции, в которой участвует аммиак. |
| 2 | Выразите уравнение в мольных пропорциях. |
| 3 | Используя данные о молярных массах, найдите количество молей аммиака. |
| 4 | Умножьте количество молей аммиака на его молярную массу, чтобы определить массу аммиака в граммах. |
Зачем нужно определение массы аммиака?

Определение массы аммиака также необходимо для выполнения стандартных процедур по манипулированию и хранению этого вещества. Правильное измерение массы позволяет избежать перевесок или недостатка при его использовании, что может привести к неконтролируемым реакциям и опасности для окружающей среды.
В лабораторных условиях определение массы аммиака требуется для проведения различных экспериментов. Это может включать изучение его свойств, токсичности, а также реакций с другими химическими веществами. Точное измерение массы аммиака дает возможность получать достоверные результаты и улучшить качество научных исследований.
В целом, знание массы аммиака является основой для понимания его свойств, использования и взаимодействия с другими веществами. Определение массы аммиака играет важную роль в химической промышленности, лабораторных исследованиях и безопасном обращении с этим веществом.
Важность точности при определении массы аммиака

Для достижения точности при определении массы аммиака необходимо следовать специальным протоколам, используя калибровочные стандарты и записывая все измерения с необходимыми описаниями и обозначениями. Также рекомендуется использовать качественные аналитические приборы с высокой степенью точности и повторяемости.
Определение массы аммиака может быть важным этапом в исследованиях или процессах, связанных с производством удобрений или азотных соединений. Например, точное определение массы аммиака позволяет контролировать процесс нитрификации в почве или оптимизировать процесс синтеза аммиака в промышленности.
Таким образом, точность при определении массы аммиака играет ключевую роль в химических исследованиях, производственных процессах и других областях, где аммиак играет важную роль. Правильное определение массы аммиака обеспечивает надежные данные и возможность принимать обоснованные решения на основе этих данных.
Классический метод определения массы аммиака в химических реакциях
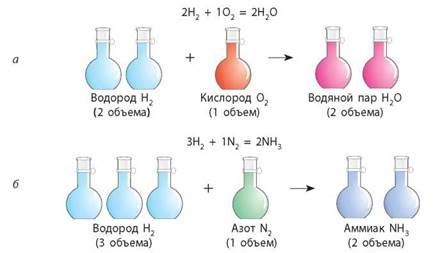
Для определения массы аммиака с помощью этого метода необходимо провести следующие шаги:
- Подготовка оборудования: необходимо подготовить пробирку, в которую будет помещено вещество, раствор аммиака и раствор кислорода.
- Проведение реакции: в пробирку помещается вещество, после чего добавляется раствор аммиака и кислорода. В результате происходит химическая реакция, в ходе которой образуется аммиак.
- Анализ полученных данных: после окончания реакции необходимо провести анализ полученных данных и определить массу аммиака, которая образовалась.
Этот метод является точным и надежным способом определения массы аммиака. Важно правильно подготовить оборудование и проводить реакцию в соответствии с инструкциями. После анализа данных можно получить точные результаты, которые помогут в дальнейших исследованиях.
Современные методы определения массы аммиака

Один из самых распространенных методов определения массы аммиака - гравиметрический метод. Он основан на использовании реакции между аммиаком и избытком соляной кислоты. Реакция приводит к образованию хлорида аммония, который может быть легко взвешен и использован для определения начальной массы аммиака.
Еще один метод - колориметрический анализ. Он основан на использовании реакции между аммиаком и избытком хлорида железа(III). Реакция приводит к образованию темно-коричневого осадка, чей цвет можно измерить и использовать для определения массы аммиака.
Также существует газовый вольтметрический метод определения массы аммиака. Он основан на измерении плотности аммиака газовым вольтметром. Путем использования соответствующей калибровочной кривой можно определить массу аммиака на основе его плотности.
Необходимо отметить, что существует множество других методов определения массы аммиака, таких как спектрофотометрия и титрация. Каждый из них имеет свои преимущества и ограничения, и выбор метода зависит от конкретной ситуации и требований эксперимента.
| Метод | Принцип | Преимущества | Ограничения |
|---|---|---|---|
| Гравиметрический | Измерение массы образовавшегося хлорида аммония | Высокая точность | Длительное время анализа |
| Колориметрический | Измерение цвета образовавшегося осадка | Быстрый и простой | Ограниченный диапазон концентраций |
| Газовый вольтметрический | Измерение плотности аммиака | Быстрый и удобный | Точность зависит от калибровки |
Таким образом, выбор метода определения массы аммиака зависит от требований эксперимента и доступности необходимых инструментов. Современные методы предлагают множество вариантов, позволяющих проводить анализ с высокой точностью и эффективностью.
Преимущества и ограничения различных методов определения массы аммиака

При изучении химических реакций важно иметь возможность определить массу аммиака, участвующего в реакции. Существуют различные методы определения массы аммиака, каждый из которых обладает своими преимуществами и ограничениями.
Одним из методов является метод газовой хроматографии. Этот метод позволяет определить содержание аммиака в газовом состоянии с высокой точностью. Однако, для использования данного метода требуется специальное оборудование и опыт, поэтому он может быть ограничен по доступности для новичков.
Другим методом является гравиметрический метод. При использовании данного метода аммиак конвертируется в твердое вещество, которое затем взвешивается. Этот метод отличается высокой точностью результатов и относительной простотой в выполнении. Однако, он может быть достаточно медленным и требовать использования сложного оборудования.
Количественный анализ методом титрования является еще одним распространенным способом определения массы аммиака. Этот метод основан на точном измерении объема раствора, необходимого для полной нейтрализации аммиака. Он обладает высокой точностью и относительной простотой в выполнении. Однако, требуется использование точных реактивов и аккуратность при выполнении эксперимента.
Выбор метода определения массы аммиака зависит от доступности оборудования, времени, точности результатов и опыта исследователя. Важно учитывать преимущества и ограничения каждого метода при выборе наиболее подходящего для конкретной ситуации.
Советы для новичков по определению массы аммиака в химических реакциях

Определение массы аммиака в химических реакциях может быть сложной задачей, особенно для новичков. Однако, с помощью некоторых советов и руководств, вы сможете более легко справиться с этой задачей и получить точные результаты.
1. Изучите химическую реакцию
Перед тем, как приступать к определению массы аммиака, важно полностью понять химическую реакцию, в которой он участвует. Изучите уравнение реакции и знайте, какие реагенты дают аммиак и с какими пропорциями.
2. Узнайте молярную массу аммиака
Определение молярной массы аммиака является важным шагом в определении его массы в химической реакции. Используйте периодическую систему элементов, чтобы найти массу аммиака в г/моль.
3. Используйте стехиометрию
Стехиометрия - это раздел химии, который изучает отношения между реагентами и продуктами в химических реакциях. Используйте стехиометрию, чтобы определить, сколько молей аммиака образуется или используется в реакции. Затем, используя молярную массу аммиака, рассчитайте его массу.
4. Не забывайте о коэффициентах реакции
Коэффициенты реакции указывают на относительное количество веществ, участвующих в реакции. Помните, что масса аммиака будет равна произведению коэффициента реакции и его молярной массы. Убедитесь, что вы правильно учли коэффициенты реакции при расчете массы аммиака.
5. Учитывайте условия реакции
Условия реакции, такие как температура и давление, могут влиять на образование и использование аммиака. Убедитесь, что вы учитываете эти факторы при расчете массы аммиака.
Следуйте этим советам, и вы сможете более успешно определять массу аммиака в химических реакциях. Помните, практика делает мастера, так что не бойтесь экспериментировать и задавать вопросы!