Атом - это основная единица материи, из которой состоят все вещества. Атом состоит из ядра и облака электронов, которые обращаются по орбитам вокруг ядра. Электрон - это элементарная частица, обладающая отрицательным зарядом.
Особенность электрона заключается в его квантовой структуре. Электрон может находиться только в определенных энергетических состояниях, называемых орбиталями. Каждая орбиталь имеет свою форму и энергию, а на каждой орбитали может находиться определенное количество электронов.
Квантовые орбитали описываются с помощью квантовых чисел: главного квантового числа, орбитального квантового числа, магнитного квантового числа и спинового квантового числа. Главное квантовое число определяет энергию орбитали, а орбитальное квантовое число - ее форму.
Роль электронов в атоме и их состояние
Каждый атом состоит из центрального ядра и облака электронов, которые обращаются вокруг него по определенным орбитам. Именно движение электронов вокруг ядра создает электрический заряд и определяет свойства атома.
Состояние электронов в атоме зависит от их энергии и расположения на орбитах.
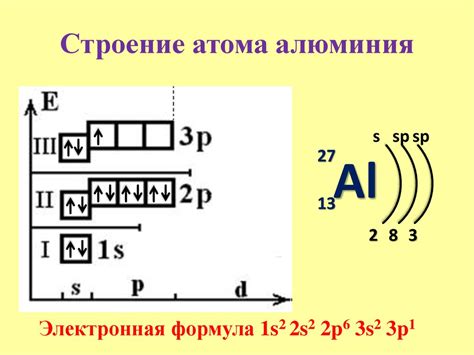
Орбиты, на которых располагаются электроны, имеют определенные энергетические уровни, называемые энергетическими оболочками. Электроны заполняют эти оболочки по определенным правилам – принципу Паули и принципу энергии минимума.
Существует также понятие подуровней энергии, которые обозначаются буквами s, p, d, f и указывают на форму электронной орбитали. На каждом энергетическом уровне могут находиться определенное количество электронов.
Электроны в атоме могут находиться в различных состояниях – возбужденном или основном.
Основное состояние – это наименьшая энергия, при которой находится электрон. Однако, электроны могут поглощать или испускать энергию и переходить в возбужденное состояние. Возбужденное состояние электронов – это временное состояние, в котором они имеют более высокую энергию и могут переходить на другие энергетические уровни.
Важно отметить, что состояние электронов в атоме имеет важное значение для объяснения различных свойств элементов и химических реакций.
Понимание роли электронов и их состояния в атоме позволяет нам глубже вникнуть в основы химии и физики, а также использовать эти знания в различных областях науки и технологий.
Особенности состояния электронов в атоме

Состояние электронов в атоме обладает некоторыми особенностями, которые определяют их поведение и взаимодействие с другими частицами. Ниже приведены основные особенности состояния электронов:
| Особенность | Описание |
|---|---|
| Квантовая механика | Состояние электронов в атоме описывается квантовой механикой, которая представляет их в виде волновых функций. Квантовая механика позволяет предсказывать и описывать вероятность нахождения электронов в определенных областях пространства. |
| Энергетические уровни | Электроны в атоме могут находиться на различных энергетических уровнях. Каждый энергетический уровень связан с определенным значением энергии. Переход электрона с одного уровня на другой сопровождается поглощением или испусканием энергии в виде квантов света. |
| Квантовые числа | Каждый электрон в атоме характеризуется набором квантовых чисел - главным, орбитальным, магнитным и спиновым. Квантовые числа определяют энергию, форму и ориентацию орбитали, а также направление спина электрона. |
| Электронные облака | Существуют области пространства вокруг ядра атома, где с наибольшей вероятностью можно обнаружить электроны. Эти области называются электронными облаками или орбиталями. Форма орбиталей зависит от значений орбитальных квантовых чисел. |
Важно отметить, что состояние электронов в атоме является квантовым и определяется набором квантовых чисел. Эти особенности состояния электронов имеют фундаментальное значение в понимании строения и свойств атомов, а также в молекулярной и атомной физике.