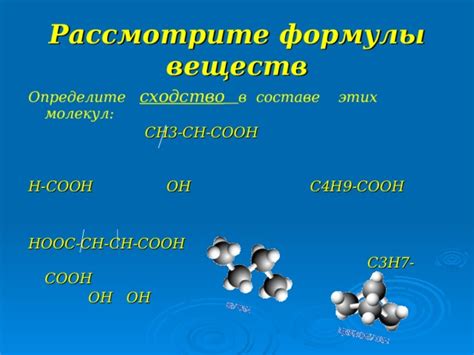
Кислота Сн3 сн он соон является одним из самых интересных и загадочных соединений в химической науке. Её название запоминается с трудом, но именно эта кислота стоит в центре внимания множества исследователей и химиков. Открыта она была еще в далеком 1985 году, но до сих пор многие детали её свойств и возможностей остаются неизвестными.
Сн3 сн он соон является одним из самых мощных оксоанон нитроксидов, обладающих уникальными физическими и химическими свойствами. Она является кислотой, образующей альдегидные и кетонные соединения при реакции с органическими веществами. Более того, она способна проявлять свойства катализатора для некоторых реакций.
Кислота Сн3 сн он соон обладает резким запахом и ярко выраженными кислотными свойствами. Её формула CuNO2 говорит сама за себя: в её составе содержится медь, азот и кислород. Это делает её темой повестки дня для химиков и научных кругов. Исследования и опыты с этой кислотой позволяют расширить границы наших знаний о химических соединениях и создавать новые материалы с уникальными свойствами.
Сн3 сн он соон: причины и последствия
Сн3 сн он соон обладает высокими ядовитыми свойствами и может вызвать серьезные последствия для здоровья человека и окружающей среды. Вдыхание паров этой кислоты может вызвать проблемы с дыхательной системой, химические ожоги и даже смерть. Контакт с кожей может привести к ожогам и раздражению, а попадание в глаза может вызвать тяжелые повреждения глазных тканей.
Одной из основных причин опасности Сн3 сн он соон является его высокая реактивность. Взаимодействие с другими веществами может привести к аварийным ситуациям, пожарам и взрывам. Кроме того, данная кислота может быть использована в качестве химического оружия, что представляет угрозу для национальной безопасности.
Помимо непосредственной опасности для здоровья и окружающей среды, Сн3 сн он соон оказывает долгосрочные последствия. Это включает загрязнение почвы, воды и воздуха, что отрицательно влияет на живые организмы и экосистемы в целом. Кроме того, использование данной кислоты при производстве удобрений может привести к накоплению нитратов в пищевых продуктах, что является потенциальной угрозой для здоровья человека.
В связи с вышеперечисленными факторами, использование Сн3 сн он соон должно быть строго регулируемым и контролируемым. Необходимы меры предосторожности и бережное обращение с этой кислотой, чтобы минимизировать риски для жизни и здоровья людей и окружающей среды.
Химический состав кислоты
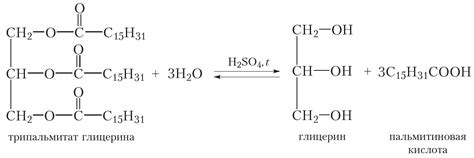
Химический состав кислот может различаться в зависимости от их типа. В основном кислоты состоят из двух компонентов:
- Протон - положительно заряженная частица, которая обеспечивает кислотность раствора. Протоны образуются из водорода, который присутствует в составе большинства кислот.
- Анион - отрицательно заряженная частица, которая образуется при диссоциации кислоты в водном растворе. Разные кислоты имеют различные анионы. Например, серная кислота образует сульфатные ионы, а хлороводородная кислота - хлоридные ионы.
Некоторые кислоты также могут содержать другие элементы в своем химическом составе, такие как кислород, азот, фосфор и другие.
Химический состав кислот определяет их свойства и способность взаимодействовать с другими веществами. Знание химического состава кислот позволяет более точно определить их использование в различных областях науки и промышленности.
Влияние кислоты на организм человека

Кислоты могут оказывать различное влияние на организм человека в зависимости от их химического состава и концентрации. Некоторые кислоты могут быть особенно опасными при контакте с кожей, глазами или слизистыми оболочками.
- Хлороводородная кислота (соляная кислота): при попадании на кожу может вызывать ожоги и раздражение. Если попадает в организм через дыхательные пути, может вызвать проблемы с дыханием и повреждение легких.
- Азотная кислота: может вызвать серьезные ожоги при контакте с кожей и глазами. Вдыхание азотной кислоты может вызвать проблемы с дыханием и раздражение дыхательных путей.
- Уксусная кислота: при попадании на кожу может вызвать раздражение и ожоги. При попадании в глаза может вызвать серьезные повреждения и затруднение зрения.
Однако, не все кислоты являются вредными для организма человека. Некоторые кислоты, такие как аскорбиновая кислота (витамин C), могут быть полезны для организма. Они играют важную роль в поддержании иммунной системы, улучшении пищеварения и укреплении костей.
Независимо от типа кислоты, всегда следует соблюдать меры предосторожности при работе с ними. Необходимо использовать защитную одежду и средства индивидуальной защиты, такие как перчатки и защитные очки. В случае контакта с кислотой, необходимо как можно скорее промыть область чистой водой и обратиться за медицинской помощью, если возникают серьезные симптомы.
Как происходит образование кислоты

Образование кислоты может происходить в различных условиях. Например, в природных условиях кислоты образуются путем окисления некоторых веществ воздухом или в результате взаимодействия с водой. Однако, кислоты также могут образовываться и в химических реакциях на промышленных предприятиях.
Процесс образования кислоты включает следующие стадии:
1. Реакция окисления. В результате окисления происходит отщепление электронов от атомов вещества. Это позволяет атомам получать положительный заряд и образовывать ионы.
2. Образование протонов. При окислении атомы вещества могут утрачивать протоны, образуя ионы водорода. Протоны являются основными носителями положительного заряда и отвечают за кислотность раствора.
3. Образование кислоты. Когда вещество отдаёт протоны, оно образует кислоту. В результате образования кислоты происходит образование водородных ионов (H+), которые обладают сильными кислотными свойствами и способны взаимодействовать с другими веществами.
Примеры образования кислот:
- Образование соляной кислоты (HCI) в результате взаимодействия хлорида натрия (NaCl) и кислорода (O2);
- Образование азотной кислоты (HNO3) при взаимодействии аммиака (NH3) и кислорода (O2).
Важно отметить, что сильные кислоты обладают высокой степенью ионизации, тогда как слабые кислоты ионизируются только частично.
Сн3 и другие виды кислот
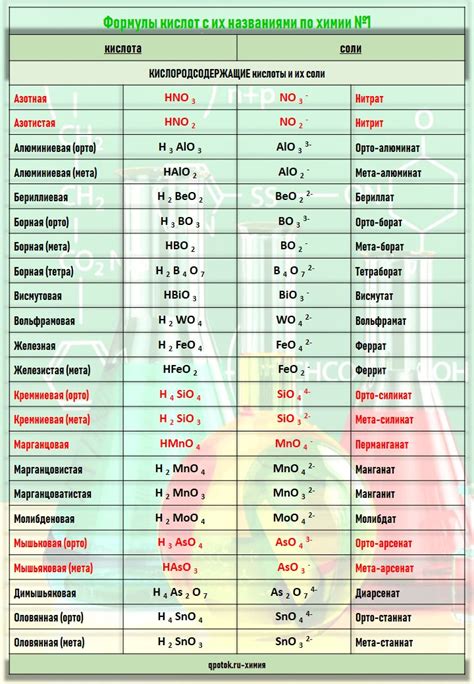
Кроме Сн3, существуют и другие виды кислот, которые часто используются в химической и научной областях.
- Серная кислота (H2SO4) – одна из наиболее распространенных кислот. Она широко используется в промышленности для производства различных материалов и химических соединений.
- Азотная кислота (HNO3) – еще одна важная кислота, используемая в химической промышленности. Она может использоваться в процессе нитрирования органических соединений.
- Фосфорная кислота (H3PO4) – кислота, которая часто применяется в сельском хозяйстве, а также в производстве удобрений и фармацевтических препаратов.
Это лишь некоторые из множества видов кислот, которые используются в различных отраслях исследований и промышленности. Каждая из них имеет свои особенности и применения, и их изучение является важным для понимания химических процессов и разработки новых технологий.
Реагент для обнаружения кислоты
Реагент Сн3 сн он соон представляет собой специально разработанное соединение, которое взаимодействует с ионами водорода (H+) в кислотной среде. При взаимодействии реагента с кислотой происходит химическая реакция, в результате которой образуется видимый цветовой или химический индикатор, позволяющий определить наличие кислоты.
При использовании реагента Сн3 сн он соон следует соблюдать осторожность и технику безопасности. Реагент является крайне реактивным и может вызывать раздражение кожи и слизистых оболочек при неправильном использовании.
Реагент Сн3 сн он соон широко применяется в различных областях, таких как химическая аналитика, биология, медицина и другие. Обнаружение кислоты является важным этапом во многих процессах и исследованиях, и реагент Сн3 сн он соон обеспечивает точность и надежность результатов.
Как обезопасить себя от кислоты

Несмотря на редкость случаев контакта с кислотой, важно знать, как обезопасить себя и предотвратить возможные последствия.
- Никогда не храните кислоту в доступном для детей месте. Поставьте ее на верхние полки в шкафу или в ящике с закрытым доступом.
- При работе с кислотой используйте защитные средства, такие как специальные перчатки, защитные очки и предупредительную одежду. Не забывайте обязательно прочитать инструкцию, чтобы знать, какие средства защиты необходимо использовать.
- Используйте кислоту только в хорошо проветриваемых помещениях. Это позволит предотвратить ингаляцию ее паров и снизить риск отравления.
- Не смешивайте кислоту с другими химическими веществами без необходимости. Это может привести к неожиданным реакциям и повысить риск возникновения опасных ситуаций.
- После работы с кислотой тщательно вымойте руки с мылом и водой. Если кислота попала на кожу, немедленно промойте ее большим количеством воды в течение нескольких минут.
- Если вы случайно попали в контакт с кислотой, сразу же вызовите медицинскую помощь и следуйте указаниям профессионалов.
- В случае попадания кислоты в глаза немедленно промойте их обильным количеством воды и обратитесь за медицинской помощью.
- Не забывайте хранить кислоту в оригинальной упаковке с надежной крышкой. Это поможет предотвратить случайное попадание кислоты на кожу или в глаза.
Практическое применение кислоты

1. Промышленность: Кислоты используются в процессе производства различных товаров. Например, серная кислота используется в производстве удобрений, красителей и пластмасс. Азотная кислота применяется в производстве взрывчатых веществ. Фосфорная кислота используется в производстве пестицидов и детергентов. Кислоты также используются в процессах очистки и обработки материалов.
2. Лабораторные исследования: Кислоты играют важную роль в химических исследованиях. Они используются для настройки pH-уровня растворов, разделения смесей и проведения реакций различных веществ. Некоторые кислоты, такие как соляная кислота и серная кислота, также используются для очистки и дезинфекции.
3. Фармацевтическая промышленность: Кислоты находят свое применение в производстве лекарственных препаратов. Они могут использоваться для создания определенных химических соединений, стабилизации и согласования pH-уровня лекарственных препаратов.
Обратите внимание, что использование кислот требует соблюдения безопасности и правил хранения. Некоторые кислоты могут быть опасными и являться ядовитыми веществами.
Опасные последствия утечки кислоты

Одной из опасностей утечки кислоты является загрязнение почвы и водных ресурсов. Кислота может проникать в грунт и попадать в подземные воды, что может привести к их загрязнению. Это может негативно сказаться на экосистеме и животных, которые обитают в этих водоемах.
Кислота может также вызвать химические ожоги и травмы при контакте с кожей или слизистыми оболочками. Это может привести к долгосрочным проблемам со здоровьем, включая ожоги, воспаления и раздражение кожи.
В случае вдыхания паров кислоты, могут возникнуть проблемы с дыханием и дыхательными путями. Это может вызывать кашель, одышку, а в некоторых случаях даже остановку дыхания.
Пожароопасность также является одним из важных аспектов утечки кислоты. Кислота может быть воспламенена в случае взаимодействия с определенными веществами или условиями, что может привести к возгоранию и пожару. В результате возможны серьезные материальные потери и опасность для жизни и здоровья людей.
В целях безопасности необходимо принимать все меры предосторожности при работе с кислотами и оперативно реагировать на утечки. Регулярные обучения и тренировки сотрудников, а также использование современного оборудования и технологий, помогут снизить риск утечек и минимизировать их возможные последствия.



