Скорость реакции - важный параметр, определяющий, как быстро происходит химическое превращение. Причины, влияющие на скорость реакции, сложны и многогранны. Однако одним из наиболее значимых факторов является использование катализатора. Чем выше эффективность катализатора, тем быстрее может протекать реакция.
Катализатор - это вещество, которое ускоряет химическую реакцию, не участвуя прямо в ней. Катализаторы могут быть различных типов: гомогенные и гетерогенные. Гомогенные катализаторы имеют одну фазу с реагентами, тогда как гетерогенные - отличаются по фазе от реагентов.
Основное преимущество катализаторов заключается в том, что они позволяют существенно сократить время реакции. Они обладают способностью активировать молекулы реагентов, что приводит к увеличению вероятности столкновений и образования продуктов реакции. Это позволяет существенно ускорить процесс и повысить его эффективность.
Катализаторы и скорость реакции: их взаимосвязь
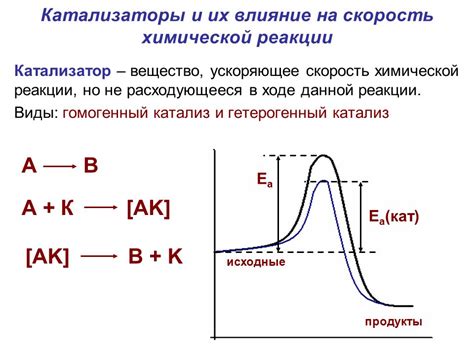
Одной из главных особенностей катализаторов является их способность снижать энергию активации, необходимую для начала реакции. Понижая этот порог, катализаторы облегчают прохождение реакции и ускоряют ее тем самым. Благодаря этому процессу, реакции, которые иначе происходили бы очень медленно или вообще не происходили, могут быть осуществлены в приемлемые сроки и условия.
Основная причина, объясняющая влияние катализаторов на скорость реакции, связана с их способностью образовывать промежуточные соединения с реагентами. Эти промежуточные соединения иногда называют активированными комплексами и позволяют более эффективно переходить от исходных веществ к продуктам реакции.
Другой важной особенностью катализаторов является их способность ускорять реакции, не самостоятельно участвуя в итоговых продуктах. Это делает их эффективными и экономически выгодными, так как они могут использоваться неоднократно и не требуют больших количеств для обеспечения быстрой реакции.
Таким образом, катализаторы играют важную роль в регулировании скорости химических реакций. Их присутствие значительно ускоряет процесс и повышает эффективность реакции. Благодаря катализаторам можно достичь более высокой скорости реакции и снизить энергетические затраты, что делает их неотъемлемой частью многих процессов и систем.
| Преимущества катализаторов: | Примеры катализаторов: |
|---|---|
| Ускоряют реакции | Ферменты |
| Позволяют проходить реакцию при низкой температуре | Перекись водорода |
| Экономически выгодны | Платина |
Каталитические свойства веществ: ключевой фактор в химических реакциях
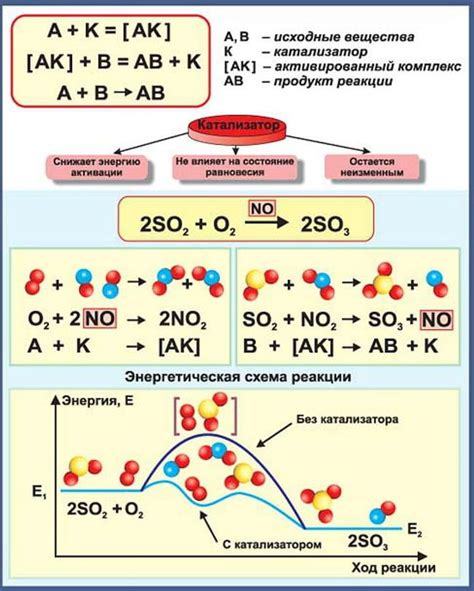
Каталитический процесс в химии – это процесс, при котором каталитическое вещество, или катализатор, ускоряет химическую реакцию, не изменяясамого катализируемого вещества и не потребляясамостоятельных химических реагентов. Катализатор представляет собой вещество, которое способно снижать активационную энергию химической реакции, делая процесс прохождения более эффективным и быстрым.
Каталитические свойства веществ влияют на множество видов химических реакций, включая органические и неорганические процессы. Важность катализаторов в современной химии трудно переоценить, так как они позволяют достичь высокой производительности и сэкономить время и ресурсы.
Особенно важно отметить, что катализаторы также способствуют снижению температуры, необходимой для протекания реакции. Это возможно благодаря тому, что катализатор направляет энергию реакции и позволяет молекулам более эффективно взаимодействовать, что в конечном итоге приводит к увеличению скорости реакции.
Важно отметить, что катализаторы не тратятся при проведении реакции и могут использоваться множество раз. Кроме того, их количество не влияет на саму химическую реакцию, однако они значительно влияют на ее скорость. Подобные свойства катализаторов позволяют снизить затраты на производство и повысить его эффективность.
Скорость реакции зависит от активности катализатора
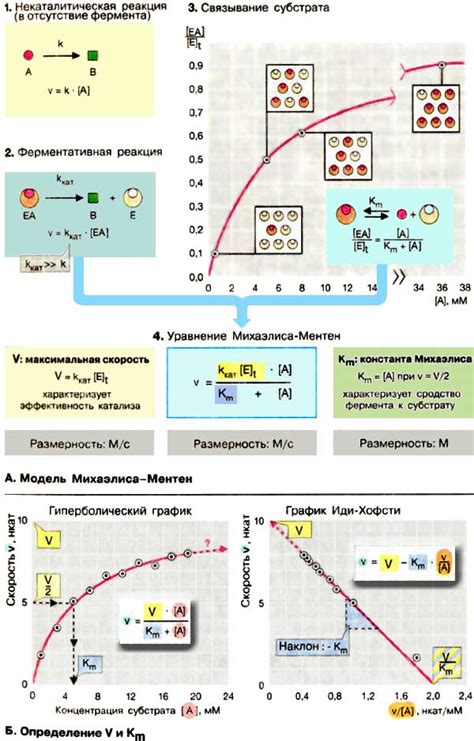
Активность катализатора определяется его способностью активировать молекулы реагентов и образовывать промежуточные соединения, что приводит к снижению энергии активации реакции. Чем выше активность катализатора, тем быстрее протекает реакция.
Активность катализатора зависит от его свойств, таких как концентрация, поверхностная площадь, степень чистоты и стабильность. Катализаторы с высокой активностью способны обеспечить быструю реакцию и эффективную трансформацию реагентов в продукты.
Однако, активность катализатора может быть уменьшена различными факторами, такими как деградация катализатора, присутствие ингибиторов, загрязнения и изменение условий реакции. В таких случаях необходимо провести дополнительные исследования и оптимизировать условия реакции для повышения активности катализатора.
Таким образом, активность катализатора играет важную роль в оптимизации скорости химических реакций. Понимание и контроль активности катализатора помогают улучшить эффективность процессов в различных сферах, от промышленности до науки.
Виды катализаторов и их влияние на скорость химических реакций
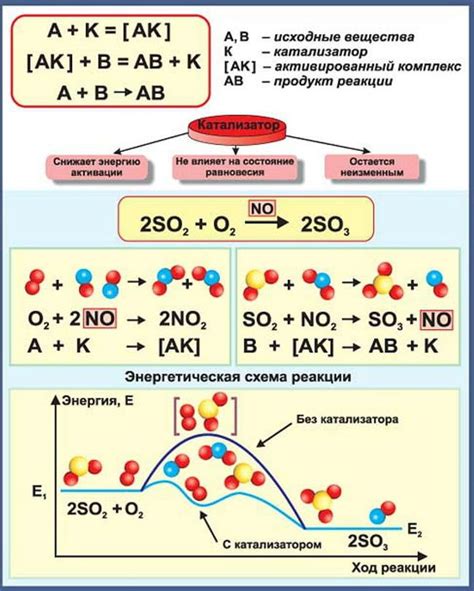
Катализаторы влияют на скорость химических реакций, повышая ее и ускоряя процесс. Они могут быть разных типов и характеризуются своим воздействием на реакцию. Рассмотрим основные виды катализаторов и их роль в химических процессах.
Гомогенные катализаторы представляют собой вещества, которые находятся в одной фазе с реагирующими веществами. Они принимают участие в химической реакции, образуя временную комплекс с реагентами, что ускоряет процесс реакции. Примером гомогенного катализатора может служить кислота или щелочь, участвующие в эстерификации или гидролизе.
Гетерогенные катализаторы являются веществами, находящимися в разной фазе с реагирующими веществами. Они образуют на своей поверхности активные центры, на которых происходит химическая реакция. Гетерогенные катализаторы широко применяются в промышленности, например, при производстве аммиака или бензина.
Ферменты или биологические катализаторы - это белковые молекулы, способные ускорить химическую реакцию в организме. Они играют важную роль в биохимических процессах и регулируют многие жизненно важные функции. Ферменты активируют реакции, происходящие при низких температурах и pH, что существенно повышает энергию активации.
Фотокатализаторы - это вещества, способные катализировать химическую реакцию при наличии света. Они поглощают энергию света и вносят изменения в химический состав вещества, ускоряя реакцию. Фотокатализаторы широко используются в фотохимических процессах и в фотоэлементах.
Влияние катализаторов на скорость химических реакций обусловлено их способностью понижать энергию активации. Катализаторы предоставляют альтернативный путь реакции, снижая энергию, необходимую для преодоления химических барьеров. Благодаря этому, реакции могут происходить при более низких температурах и в более короткие сроки.
Таким образом, выбор катализаторов может значительно повлиять на скорость химической реакции, делая ее более эффективной и экономичной.
Катализаторы: секрет ускорения химических процессов
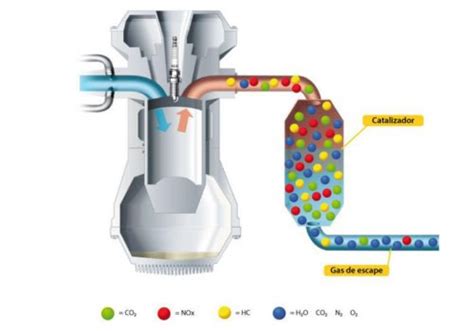
Главное свойство катализаторов – увеличение скорости реакции путем понижения активационной энергии, то есть энергии, необходимой для начала химической реакции. Благодаря катализаторам реакции происходят существенно быстрее и при ниже температуре, что является одним из главных преимуществ использования катализаторов.
Катализаторы могут быть различных типов: гетерогенные и гомогенные. Гетерогенные катализаторы находятся в разных фазах с реакционными компонентами, например, металл на поверхности твердого катализатора, а гомогенные катализаторы находятся в одной фазе с реагентами и продуктами реакции.
Катализаторы широко применяются в химической промышленности. Они используются для ускорения реакций, снижения температуры и давления, экономии энергии и сырья. Благодаря катализаторам многие сложные и долгие химические процессы можно проводить в более короткое время и с более полным превращением исходных веществ.
Важно отметить, что катализаторы сами не участвуют в реакции и не расходуются при этом. Они способны образовывать промежуточные соединения с реагентами, которые затем разлагаются и возвращаются в исходное состояние. Таким образом, катализаторы могут использоваться многократно и быть эффективными в длительных периодах времени.
Катализаторы играют важную роль не только в промышленности, но и в органической и неорганической химии, биологии и других отраслях науки. Они являются ключевыми компонентами при разработке новых технологий и изобретении новых химических соединений.
Таким образом, катализаторы являются незаменимым средством для ускорения химических процессов. Они способствуют сокращению времени и энергозатрат, а также обеспечивают высокую эффективность процессов. Именно благодаря катализаторам многие сложные химические реакции становятся возможными и приносят пользу человечеству.