Скорость электрона в модели атома – это одна из ключевых характеристик, определяющих его движение и поведение. Изучение движения электрона позволяет нам лучше понять структуру атома и его физические свойства. Хотя модель атома является упрощенной, она помогает нам представить себе, как электроны движутся вокруг ядра и взаимодействуют между собой.
Скорость электрона в атоме может быть разной и зависит от его энергии и орбитальной скорости. В модели атома, предложенной Нильсом Бором в 1913 году, электроны движутся по круговым орбитам вокруг ядра. На каждой орбите электрон имеет определенную энергию и скорость. Скорость электрона на каждой орбите оказывается постоянной и пропорциональной его энергии.
Формула модели Бора позволяет вычислить скорость электрона на определенной орбите. Эта формула основана на принципе неопределенности Гейзенберга и позволяет найти радиус орбиты и скорость электрона с помощью энергии орбиты. Согласно этой формуле, скорость электрона обратно пропорциональна радиусу орбиты и зависит от константы Планка и массы электрона.
Узнайте, какова скорость движения электрона в атоме

В модели атома, разработанной Нильсом Бором в 1913 году, электроны движутся вокруг ядра на определенных энергетических уровнях. Тем не менее, определить точную скорость движения электрона в атоме достаточно сложно из-за свойств квантовой физики.
Скорость электрона зависит от его энергии и радиуса орбиты. Бор предположил, что радиус орбиты обратно пропорционален энергии электрона. Он также установил, что энергия электрона должна быть квантована и иметь определенные значения.
Таким образом, скорость электрона в модели атома Бора может быть вычислена, используя известные физические константы и энергетические уровни. Однако эта скорость представляет собой только математическую модель и не отражает реальное движение электрона внутри атома.
В современных моделях атома, таких как квантовая механика, движение электрона описывается не в терминах скорости и орбитального радиуса, а в терминах вероятности его нахождения в определенных областях пространства, называемых орбиталями.
Таким образом, точная скорость движения электрона в атоме не имеет смысла в контексте современных моделей атома. Вместо этого, мы рассматриваем вероятность нахождения электрона в определенном состоянии или области пространства.
Модель атома
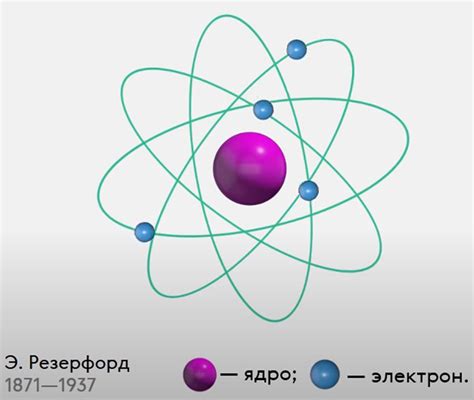
Модель атома, разработанная Нильсом Бором в начале 20 века, представляет собой упрощенную модель действительной структуры атома. Согласно этой модели, атом состоит из положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные электроны.
В модели атома Бора электроны не могут двигаться по любым орбитам, а могут существовать только на определенных энергетических уровнях. Каждый электрон находится на одном из этих уровней и имеет определенную энергию. При переходе электрона с одного уровня на другой происходит излучение или поглощение энергии в виде фотонов света.
Скорость электрона в модели атома неопределена. Согласно квантовой механике, в модели Бора электрон может существовать только на дискретных энергетических уровнях и может перемещаться с одного уровня на другой. Однако, в пределах определенного уровня, скорость электрона может быть любой.
Модель атома Бора была важным прорывом в понимании структуры атома и электронного движения. Она помогла объяснить спектральные линии атомов и открыла путь к развитию квантовой механики.
Краткий обзор структуры атома
Протоны - это положительно заряженные частицы, которые находятся в ядре атома. Количество протонов определяет характеристики химического элемента.
Нейтроны - это нейтральные частицы, которые также находятся в ядре атома. Они несут электрический заряд, равный нулю.
Электроны - это отрицательно заряженные частицы, которые движутся вокруг ядра атома по определенным орбитам. Они обладают массой гораздо меньшей, чем у протонов и нейтронов. Скорость электрона в модели атома не имеет фиксированного значения и может меняться в зависимости от энергии, которую принимает электрон.
Структура атома включает в себя ядро, состоящее из протонов и нейтронов, и электронные оболочки, на которых движутся электроны. Электроны расположены на определенных уровнях энергии, называемых энергетическими уровнями или оболочками.
Знание структуры атома и поведения электронов помогает понять различные аспекты химических реакций и свойств веществ.
Электронное движение
В модели атома, скорость электрона определяется его энергией. Согласно квантовой механике, энергия электрона связана с его квантовым состоянием и может иметь дискретные значения. Это означает, что электрон может занимать определенные энергетические уровни, а его скорость соответствует разности энергий между этими уровнями.
Для простоты можно представить, что электрон движется по орбитальной траектории вокруг ядра атома. Орбитальные траектории также имеют определенные энергетические уровни, называемые энергетическими оболочками. Скорость электрона на каждой оболочке зависит от радиуса орбиты и энергии оболочки.
Например, если электрон переходит на более высокую энергетическую оболочку, то его скорость увеличивается, так как энергия увеличивается. Если же электрон переходит на более низкую энергетическую оболочку, то его скорость уменьшается.
Важно отметить, что в классической модели атома, где электрон движется по орбитальной траектории, скорость электрона никогда не достигает световой скорости. Скорость электрона в модели атома может быть порядка 1% от световой скорости, что достаточно мало по сравнению с скоростью света.
| Энергетическая оболочка | Скорость электрона |
|---|---|
| Оболочка 1 | 0.01c |
| Оболочка 2 | 0.02c |
| Оболочка 3 | 0.03c |
Таким образом, скорость электрона в модели атома зависит от его энергетического уровня и радиуса орбиты, и может изменяться при переходе между оболочками.
Раскрытие секретов движения электрона в модели атома

Одной из важнейших характеристик движения электрона является его скорость. В модели атома, представленной Нильсом Бором, скорость электрона определяется его расстоянием от ядра, а также энергией электрона. Чем больше энергия электрона, тем больше его скорость.
Именно энергия электрона является ключевым фактором, определяющим его скорость. В зависимости от уровня энергии, электрон может находиться на определенной орбите или энергетическом уровне. Наиболее близкий к ядру уровень содержит электроны с наибольшей энергией и наибольшей скоростью.
| Орбита | Скорость электрона |
|---|---|
| Нижняя орбита | Наименьшая |
| Средняя орбита | Средняя |
| Верхняя орбита | Наибольшая |
Таким образом, скорость электрона в модели атома зависит от его расстояния от ядра и энергии, которой он обладает. Изучение и понимание движения электрона внутри атома позволяет углубить наши знания о строении вещества и проводить более точные расчеты в химических и физических процессах.
Квантовая механика

Согласно модели атома, представленной Нильсом Бором, скорость электрона вокруг ядра не может быть определена точно. Вместо этого, квантовая механика говорит нам о вероятностном поведении электрона. Квантовая механика предлагает использовать волновую функцию, которая описывает вероятность нахождения электрона в определенном состоянии или местоположении.
Скорость электрона в модели атома зависит от его энергии и квантового состояния. Электрон может находиться в различных орбиталях, каждая из которых имеет определенный радиус и энергию. Скорость электрона изменяется при переходе между орбиталями, вызванных поглощением или излучением фотона.
Вместо точного значения скорости электрона, квантовая механика предлагает рассчитывать среднеквадратичное значение скорости, которое является средним значением скорости электрона в определенном состоянии или составляющее состояние.
Квантовая механика изменяет наше представление о движении электронов в атомах и дает нам новые инструменты для понимания атомной структуры и свойств вещества. Она позволяет предсказывать и объяснять электронные уровни, химическую активность и спектральные линии атомов.
Как квантовая механика объясняет движение электрона

В классической модели атома Резерфорда-Бора утверждается, что электроны движутся по стационарным орбитам вокруг ядра и подчиняются законам классической механики. Однако эта модель не объясняет ряда наблюдаемых явлений, таких как спектральные линии и магнитное поле атома.
Квантовая механика предлагает новый подход к пониманию движения электрона в атоме. Она использует понятие волновой функции, которая описывает вероятность обнаружить электрон в определенном состоянии, таком как энергия и положение.
Согласно принципу неопределенности Гейзенберга, квантовая механика утверждает, что точное положение и скорость электрона невозможно одновременно определить. Вместо этого, мы можем говорить только о вероятностном распределении возможных состояний электрона.
Движение электрона в атоме рассматривается как набор дискретных энергетических уровней, так называемых квантовых состояний. Электрон может переходить с одного уровня на другой, излучая или поглощая кванты энергии в виде фотонов. Этот процесс объясняет спектральные линии, наблюдаемые при измерении электромагнитного излучения от атомов.
| Квантовая механика | Классическая модель атома |
|---|---|
| Описывает движение электрона вероятностными функциями | Описывает движение электрона по стационарным орбитам |
| Использует концепцию квантовых состояний | Не использует концепцию квантовых состояний |
| Объясняет спектральные линии и другие наблюдаемые явления | Не объясняет спектральные линии и другие наблюдаемые явления |
Таким образом, квантовая механика предоставляет более точное и полное объяснение движения электрона в атоме, чем классическая модель. Она позволяет ученым понять и предсказать различные явления, которые наблюдаются в микромире и играют важную роль в современной физике и технологии.
Определение скорости

В квантовой механике скорость электрона может быть представлена с помощью вероятностной функции, которая описывает его движение вокруг ядра атома. Эта функция позволяет определить вероятность нахождения электрона в определенном состоянии с заданной скоростью.
Однако, в классической модели атома, скорость электрона может быть вычислена как отношение его кинетической энергии к его импульсу:
v = p / m
где v - скорость электрона, p - импульс электрона, m - его масса.
Таким образом, скорость электрона будет зависеть от его импульса и массы. Однако, в контексте модели атома, скорость электрона имеет вероятностную природу и не может быть точно определена в классическом смысле.
Поэтому, определение скорости электрона в модели атома требует использования квантовой механики и математических методов, которые позволяют описать его вероятностное поведение.
Чем определяется скорость электрона в модели атома
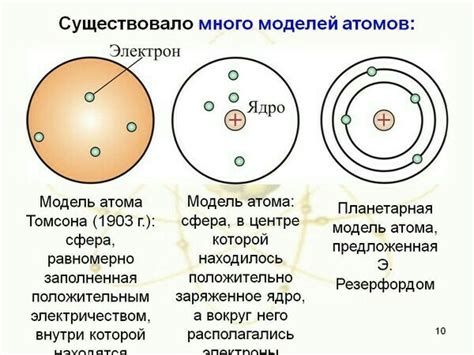
Скорость электрона в модели атома определяется рядом факторов, включая массу электрона, энергетический уровень атома и принцип неопределенности Гейзенберга.
Масса электрона, которая является константой, влияет на его движение, так как масса определяет инерцию и способность тела сопротивляться изменению своего состояния движения. Это означает, что электрон с большей массой будет иметь более низкую скорость, чем электрон с меньшей массой при одинаковой энергии.
Энергетический уровень атома также влияет на скорость электрона. Энергия электрона связана с его скоростью, причем чем выше энергетический уровень, тем больше энергии у электрона и тем выше его скорость. На каждом энергетическом уровне существуют конкретные разрешенные значения скоростей электрона, которые соответствуют его дискретным орбитам.
Кроме того, принцип неопределенности Гейзенберга гласит, что невозможно точно определить одновременно и скорость, и положение частицы. Это означает, что скорость электрона является статистическим средним значением и может меняться в зависимости от измерений и опыта.
В итоге, скорость электрона в модели атома определяется его массой, энергетическим уровнем и принципом неопределенности Гейзенберга. Эта скорость имеет физическую интерпретацию и важна для понимания движения электронов в атоме.
Типичные скорости электронов
Скорость электрона в модели атома зависит от его энергетического состояния и от того, в какой орбитали он находится. В общем случае, электрон может двигаться со скоростью от нуля до близкой к скорости света.
Наибольшая скорость электрона может быть достигнута, когда его энергия находится на самом высоком уровне, например, во внешней электронной оболочке. В этом случае, электрон может двигаться со скоростью, близкой к скорости света, порядка 299 792 458 метров в секунду.
Однако, внутри атома, скорость электронов может быть намного меньше, особенно в случае, когда электрон находится на низших энергетических уровнях или в более внутренних оболочках.