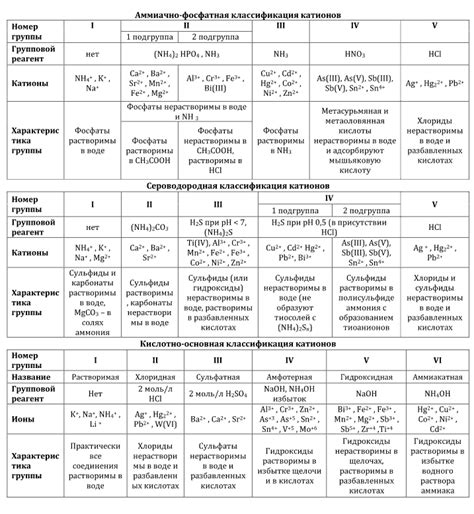
Карбонаты катионов второй группы - это соединения, которые образуются при сочетании металлов второй группы с карбонатным ионом CO32-. Вторая группа периодической системы состоит из металлов, которые имеют общую характеристику - они довольно легко образуют соединения с карбонатным ионом.
Растворение карбонатных соединений является важным процессом в химии. Карбонаты катионов второй группы зачастую обладают интересными свойствами, такими как способность образовывать красивые и кристаллические соединения, а также использоваться в производстве различных материалов.
Однако, не все вещества имеют способность растворять эти соединения. Растворение карбонатов катионов второй группы зависит от многих факторов, таких как растворитель, температура и pH окружающей среды.
Некоторые вещества, такие как кислоты, имеют возможность растворять карбонаты катионов второй группы. Их действие основано на образовании ионов в растворе, что приводит к разложению карбонатов на соответствующие ионы металла и углекислый газ. В результате происходит растворение соединения и образуется раствор с катионами второй группы.
Список веществ, растворяющих карбонаты катионов второй группы
1. Соляная кислота (HCl): Хлороводородная кислота образует реакцию с карбонатами катионов второй группы, образуя соответствующий соль и углекислый газ.
2. Нитрат аммония (NH4NO3): Растворение карбонатов катионов второй группы в нитрате аммония происходит при образовании аммония и углекислого газа.
3. Лимонная кислота (C6H8O7): Лимонная кислота используется для растворения карбонатов катионов второй группы, образуя соответствующие соли и углекислый газ.
4. Этилендиаминтетрауксусная кислота (EDTA): Этилендиаминтетрауксусная кислота осуществляет комплексообразование с карбонатами катионов второй группы, что приводит к их растворению.
5. Ацетонитрил (CH3CN): Ацетонитрил взаимодействует с карбонатами катионов второй группы, образуя соответствующие соли и углекислый газ.
6. Формиат натрия (HCOONa): Растворение карбонатов катионов второй группы в формиате натрия происходит при образовании соответствующих солей и углекислого газа.
7. Фосфат натрия (Na3PO4): Фосфат натрия используется для растворения карбонатов катионов второй группы, образуя соответствующие соли и углекислый газ.
8. Гидроксид натрия (NaOH): Растворение карбонатов катионов второй группы в гидроксиде натрия происходит при образовании соответствующих солей и воды.
9. Гидроксид калия (KOH): Реакция карбонатов катионов второй группы с гидроксидом калия приводит к образованию соответствующих солей и воды.
10. Этиловый спирт (C2H5OH): Этиловый спирт растворяет карбонаты катионов второй группы, образуя соответствующие соли и углекислый газ.
Вещества, обладающие способностью растворять карбонаты катионов второй группы

Первым таким веществом является аммиак. Неорганические растворы аммиака, такие как водный раствор аммиака (NH4OH), могут использоваться для растворения карбонатов катионов второй группы. Аммиак образует комплексы с металлами и обладает щелочными свойствами, что позволяет ему разрушать решетку карбонатного соединения, способствуя его растворению.
Кислоты также могут быть использованы для растворения карбонатов катионов второй группы. Например, хлороводородная кислота (HCl) или серная кислота (H2SO4) могут быть применены для растворения карбонатов кальция, стронция и бария. Уксусная кислота (CH3COOH) также способна растворять эти карбонаты.
При использовании аммиака или кислот особую осторожность следует соблюдать из-за их высокой токсичности и коррозионности. Растворение карбонатов катионов второй группы осуществляется с образованием газа (например, СО2), который может быть легко определен и использован для идентификации данных катионов.
Активность веществ, способных растворять карбонаты катионов второй группы
Вода является одним из основных растворителей, способных растворять карбонаты катионов второй группы. Процесс растворения происходит благодаря диссоциации воды на ионы водорода и гидроксида. Гидроксидные ионы образуют комплексы с карбонат-ионами, что приводит к дальнейшему растворению карбонатов.
Кислоты также способны растворять карбонаты катионов второй группы. Кислотное окружение обеспечивает протонацию карбонат-ионов, образование угольной кислоты и дальнейшее ее диссоциативное растворение. Таким образом, карбонаты могут быть растворены в результате реакции с кислотами.
Комплексообразователи также проявляют активность в растворении карбонатов катионов второй группы. Эти вещества обладают способностью образовывать стабильные комплексы с карбонат-ионами, что снижает их растворимость и способствует выделению осадка из раствора. Такие комплексы образуются с ионами, такими как аммиак, этилендиамин и другими.
Механизмы растворения карбонатов катионов второй группы
Карбонаты катионов второй группы, такие как карбонат кальция (CaCO3), карбонат магния (MgCO3) и карбонат стронция (SrCO3), могут растворяться в воде и других растворителях благодаря определенным механизмам.
Один из основных механизмов растворения карбонатов катионов второй группы - это реакция с кислородом воды. Вода содержит молекулы кислорода, которые могут взаимодействовать с карбонатами, образуя гидроксиды и углекислый газ. Например, реакция растворения карбоната кальция может быть представлена следующим уравнением:
| CaCO3 | + | H2O | + | O2 | → | Ca(OH)2 | + | CO2 |
|---|
Карбонаты катионов второй группы могут также растворяться под воздействием кислот. Кислотные реакции приводят к образованию солей и обмену ионами. Например, карбонат кальция может реагировать с соляной кислотой следующим образом:
| CaCO3 | + | 2HCl | → | CaCl2 | + | CO2 | + | H2O |
|---|
Кроме того, карбонаты катионов второй группы могут растворяться в растворах других солей или сложных соединений. В данном случае механизм растворения связан с обменом ионами или комплексообразованием.
Все эти механизмы растворения карбонатов катионов второй группы являются комплексными процессами, способствующими образованию новых соединений и превращению карбонатов в растворимые формы.
Влияние растворения карбонатов катионов второй группы на окружающую среду

Растворение карбонатов катионов второй группы, таких как осаждение конкретных минеральных соединений, может оказывать негативное влияние на окружающую среду.
Карбонаты катионов второй группы можно обнаружить в природной среде, как например, в водах рек, озер и океанов, а также в грунте и почве. При растворении этих карбонатов в воде, образуются ионы кальция, магния, свинца и других металлов, которые могут стать причиной загрязнения водных экосистем.
Растворение карбонатов катионов второй группы может привести к снижению pH воды и созданию кислотного окружения. Это может негативно сказаться на растениях и животных, обитающих в водных экосистемах, и привести к снижению их популяции или даже исчезновению. Кроме того, некоторые виды микроорганизмов могут быть чувствительны к изменениям pH и вязкости воды, что также может повлиять на экологическую ситуацию.
Растворение карбонатов катионов второй группы может также способствовать образованию солевых отложений, что может быть проблемой для промышленных и коммунальных объектов, связанных с использованием воды. Солевые отложения могут приводить к снижению эффективности работы оборудования, а также к возможным поломкам и повреждениям.
Таким образом, растворение карбонатов катионов второй группы может иметь широкое влияние на окружающую среду, от водных экосистем до промышленных и коммунальных объектов. Понимание этих процессов и их последствий является важным для разработки мер по охране окружающей среды и устойчивому развитию.