Щелочные и щелочноземельные металлы - это основные элементы периодической таблицы, которые обладают высокой реактивностью. Они способны образовывать сильные химические соединения с различными веществами. Химические реакции, в которых участвуют эти металлы, могут быть весьма впечатляющими и даже опасными.
Щелочные металлы, такие как литий, натрий, калий, рубидий, цезий и франций, реагируют с водой с образованием газа и обильным выделением тепла. Это реакция, называемая гидролизом. При взаимодействии с водой образуется щелочное растворение, содержащее щелочи, а именно гидроксиды щелочных металлов. Это является отличительной чертой этой группы элементов.
Щелочноземельные металлы, включая бериллий, магний, кальций, стронций, барий и радий, также реагируют с водой и образуют гидроксиды, хотя реакция протекает гораздо медленнее, чем у щелочных металлов. Эти металлы также реагируют с кислородом из воздуха, образуя оксиды. Особенно интенсивная реакция происходит с питьевой водой, наличие металлов в которой нежелательно, так как они могут быть токсичными для организма.
Взаимодействие щелочных и щелочноземельных металлов с...

Взаимодействие щелочных и щелочноземельных металлов с водой:
Щелочные и щелочноземельные металлы активно реагируют с водой. При погружении металлического образца в воду происходит образование гидроксида металла и выделение водорода. Реакция происходит очень интенсивно и может сопровождаться выделением тепла и образованием пузырьков.
Например, литий (Li) реагирует с водой с образованием гидроксида лития (LiOH) и выделением водорода (H2):
2Li + 2H2O → 2LiOH + H2
Взаимодействие щелочных и щелочноземельных металлов с кислородом:
Когда щелочные и щелочноземельные металлы вступают в контакт с кислородом, происходит окисление. Это означает, что металлы реагируют с кислородом и образуют оксиды. Например, натрий (Na) реагирует с кислородом и образует оксид натрия (Na2O).
4Na + O2 → 2Na2O
Взаимодействие щелочных и щелочноземельных металлов с кислотами:
Щелочные и щелочноземельные металлы реагируют с кислотами, образуя соли и выделяя водород. Например, натрий (Na) реагирует с соляной кислотой (HCl), образуя хлорид натрия (NaCl) и выделяя водород (H2):
2Na + 2HCl → 2NaCl + H2
Эти реакции относятся к типу обмена, когда металл заменяет водород в кислоте, образуя соль.
Взаимодействие щелочных и щелочноземельных металлов с неметаллами:
Щелочные и щелочноземельные металлы реагируют с неметаллами, например, с кислородом, серой и галогенами. При этом образуются соответствующие оксиды, сульфиды и галогениды металлов. Например, натрий (Na) реагирует с хлором (Cl2), образуя хлорид натрия (NaCl):
2Na + Cl2 → 2NaCl
Взаимодействие с щелочными и щелочноземельными металлами может зависеть от условий, таких как температура и концентрация веществ. Однако, в любом случае, эти металлы обладают химической активностью и проявляют свои способности взаимодействовать с различными элементами и соединениями.
Реакция щелочных и щелочноземельных металлов с водой
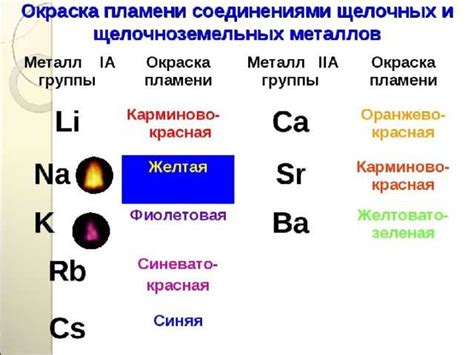
Щелочные и щелочноземельные металлы, такие как натрий, калий, магний и кальций, проявляют очень активную реакцию с водой. При контакте с водой они выделяются водородный газ и образуют гидроксиды металлов.
Реакция начинается с образования гидроксида металла (NaOH, KOH, Mg(OH)2, Ca(OH)2) за счет реакции металла с водой:
Metal + H2O → Metal(OH) + H2
Водородный газ выделяется в виде пузырьков и воспламеняется при соприкосновении с огнем или источником искры.
Обратите внимание: температура реакции может увеличиваться и образовываться высокотемпературные гидроксиды, которые могут приводить к возгоранию металла.
В связи с этим, реакция щелочных и щелочноземельных металлов с водой является чрезвычайно опасной и требует осторожности при её проведении.
Реакция щелочных и щелочноземельных металлов с кислородом

Щелочные и щелочноземельные металлы реагируют с кислородом воздуха, образуя оксиды. Это заметные химические реакции, которые можно наблюдать при контакте этих металлов с воздухом в обычных условиях.
Взаимодействие металлов с кислородом происходит следующим образом: металл реагирует с кислородом, образуя оксид металла. Реакция идет с выделением тепла.
Например, щелочные металлы, такие как литий, натрий и калий, реагируют с кислородом воздуха, образуя соответствующие оксиды. Литий соединяется с кислородом, образуя оксид лития (Li2O), натрий образует оксид натрия (Na2O), а калий образует оксид калия (K2O).
Щелочноземельные металлы, такие как магний, кальций и стронций, также реагируют с кислородом, образуя соответствующие оксиды. Например, магний образует оксид магния (MgO), кальций образует оксид кальция (CaO), а стронций образует оксид стронция (SrO).
Реакция металлов с кислородом является одной из основных свойств, которое позволяет отличать эти металлы от других химических элементов. Оксиды металлов обладают специфическими свойствами и применяются в различных отраслях промышленности и науке.
Реакция щелочных и щелочноземельных металлов с кислотами

Щелочные и щелочноземельные металлы реагируют с кислотами и образуют соли и водород. Реакция происходит исключительно с активными кислотами и зависит от химической реакционной способности металла и его электрохимического потенциала.
Во время реакции активные металлы отдают свои электроны, образуя положительные ионы, которые растворяются в воде. Водород выделяется в результате реакции активного металла с кислородом кислоты.
Давайте рассмотрим реакцию натрия (Na) с соляной кислотой (HCl) в очень простой форме и запишем строгохимическое уравнение:
| Реактанты | Продукты |
|---|---|
| 2Na (натрий) + 2HCl (соляная кислота) | 2NaCl (хлорид натрия) + H2 (водород) |
Такая реакция протекает только между активной кислотой (HCl) и щелочным металлом (Na). Мы видим, что натрий (Na) реагирует с соляной кислотой (HCl), образуя хлорид натрия (NaCl) и выделяя водород (H2).
Эта реакция может быть представлена следующим образом:
2Na (s) + 2HCl (aq) → 2NaCl (aq) + H2 (g)
Такие реакции происходят, когда щелочные и щелочноземельные металлы вступают в контакт с подходящими кислотами. Эти реакции имеют множество промышленных и практических применений и изучаются в рамках общего представления о химических реакциях между металлами и кислотами.
Щелочные и щелочноземельные металлы как восстановители

Как известно, процесс восстановления – это химическая реакция, которая приводит к увеличению валентности атома или иона вещества благодаря передаче электронов. Щелочные и щелочноземельные металлы благодаря своей низкой ионизационной энергии и низкому электроотрицательности активно отдают электроны другим веществам.
Эти металлы обладают сильной тенденцией к окислению, что обусловлено их электронной структурой. Наиболее активными восстановителями из щелочных металлов являются литий и натрий, а из щелочноземельных металлов – магний и алюминий.
Восстановительные свойства щелочных и щелочноземельных металлов широко используются в различных областях науки и техники. Например, они применяются при получении металлов из их окислов, в процессе электролиза, а также в химической промышленности для восстановления различных соединений.
- Щелочные и щелочноземельные металлы могут восстанавливать оксиды и галогены. Например, натрий восстанавливает хлор из хлорида натрия:
- Они также способны восстанавливать гидроксиды металлов. Например, магний может восстановить гидроксид железа:
2Na + Cl2 → 2NaCl
Mg + Fe(OH)2 → Mg(OH)2 + Fe
Таким образом, щелочные и щелочноземельные металлы проявляют свою химическую активность и восстановительные свойства во многих химических реакциях, что определяет их широкое использование в различных отраслях науки и промышленности.
Аммиаком и аммиачными солями

Щелочные и щелочноземельные металлы реагируют с аммиаком и аммиачными солями, образуя соответствующие аммиакаты.
Аммиак (NH3) является сильным основанием и взаимодействует с металлами, образуя аммиакаты, которые обладают рядом интересных свойств.
Реакция между металлом и аммиаком обычно происходит с выделением водорода. Металл переходит в ионный вид и образуется аммиачно-солевой комплекс. Например, реакция натрия (Na) с аммиаком приводит к образованию натрий аммиаката:
2Na + 2NH3 → 2NaNH2 + H2
Аммиакаты обычно образуют безцветные или легко растворимые в воде соединения. Эти соединения используются в различных сферах, например, в химической промышленности, лабораторных исследованиях и в качестве химических реагентов.
Аммиачные соли, такие как аммиачная соль карбоната (NH4)2CO3), также образуются при реакции металлов с аммиаком. Эти соединения часто используются в качестве удобрений и в производстве стекла.
Реакция металлов с аммиаком и аммиачными солями является одним из способов получения аммиачатов и аммиачных солей, которые имеют широкий спектр применения в различных отраслях науки и промышленности.