Алюминий – это металл, который широко применяется в различных отраслях промышленности и быта. Один из самых известных и распространенных металлов, алюминий массово используется в авиации, строительстве, производстве электротехнического оборудования и многих других сферах. Более того, алюминий обладает рядом физических и химических свойств, реакции которого происходят при комнатной температуре.
При взаимодействии с воздухом алюминий образует на поверхности оксидную пленку, защищающую его от окисления. Это позволяет использовать его в качестве конструкционного материала, который не подвержен коррозии. Однако, при повышенной влажности или при контакте с агрессивными средами алюминий может подвергаться окислению.
Кроме того, алюминий реагирует с растворами щелочей, в частности, натрия и калия гидроксидов. Эти реакции происходят при комнатной температуре и приводят к образованию соответствующих солей алюминия. Также алюминий реагирует с многими кислотами, например, соляной, серной и солянокислой, образуя соли и выделяя водород. Эти реакции сопровождаются выделением тепла и являются химическими процессами, которые можно наблюдать в повседневной жизни.
Алюминий и его реакции при комнатной температуре

Алюминий, являясь одним из самых распространенных металлов на Земле, обладает рядом уникальных свойств, которые обуславливают его широкое использование в различных отраслях промышленности и повседневной жизни.
При комнатной температуре алюминий обладает высокой химической инертностью, что позволяет ему не образовывать оксидационные слои на поверхности при обычных условиях. Это делает его устойчивым к коррозии и придает ему блестящий внешний вид.
Однако алюминий может реагировать с определенными веществами при комнатной температуре, что приводит к образованию различных продуктов.
Например, алюминий может реагировать с кислотами при контакте, образуя соли и высвобождая водород. Такая реакция наблюдается, например, при взаимодействии алюминия с соляной кислотой:
- Алюминий + соляная кислота → соль алюминия + водород
Кроме того, алюминий может реагировать с щелочами, например, с натрием. При этом образуется соединение алюминия с натрием:
- Алюминий + натрий → алюминий-натриевое соединение
Также алюминий может реагировать с некоторыми халогенами, например, с хлором или бромом. При этом образуются хлорид алюминия или бромид алюминия соответственно:
- Алюминий + хлор → хлорид алюминия
- Алюминий + бром → бромид алюминия
Такие реакции алюминия с различными веществами при комнатной температуре имеют широкое практическое применение в различных отраслях промышленности. Например, реакция алюминия с соляной кислотой используется при получении солей алюминия, которые находят применение как сырье для производства красителей, лекарств и других химических веществ.
Химические свойства

Алюминий обладает высокой химической активностью и реагирует с многими веществами при комнатной температуре.
Он реагирует с кислородом из воздуха, образуя тонкую пассивную пленку оксида, которая предотвращает дальнейшую коррозию металла.
Алюминий легко реагирует с кислотами, образуя соли и выделяяся водород. Реакция с концентрированными агрессивными кислотами, такими как соляная или серная, может привести к разрушению металла.
Металл может реагировать с щелочами, особенно концентрированными растворами щелочи, образуя алюминаты и выделяяся водород.
Алюминий также реагирует с характерными веществами, такими как бром, хлор, фтор и йод, образуя соответствующие галогениды.
Также стоит отметить, что алюминий является редким металлом, реагирующим с жидким аммиаком при комнатной температуре, образуя алюминийаммиачные соединения.
Взаимодействие с кислородом
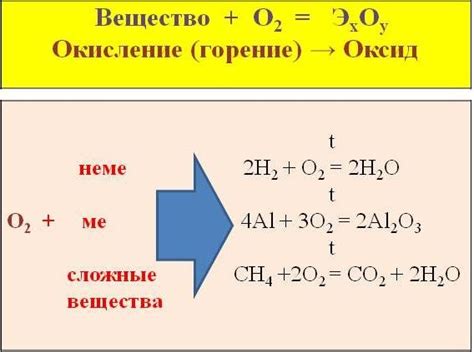
Взаимодействие алюминия с кислородом приводит к образованию оксидной пленки, которая имеет белый цвет. Оксидный слой обычно является очень тонким, всего несколько нанометров, но он оказывает эффективную защиту металла от окисления.
Оксидный слой устойчив к дальнейшему взаимодействию с кислородом и не пропускает его в глубину металла. Это делает алюминий отличным материалом для использования в различных отраслях, включая аэрокосмическую и автомобильную промышленности.
Реакция с водой и влажным воздухом
Алюминий активно реагирует с водой, образуя гидроксид алюминия (Al(OH)3) и выделяя водород (H2). Реакция протекает с выделением тепла и обычно сопровождается потрескиванием и шипением.
Реакция алюминия с водой может быть описана следующим химическим уравнением:
| Алюминий (Al) | + | Вода (H2O) | → | Гидроксид алюминия (Al(OH)3) | + | Водород (H2) |
Реакция алюминия с влажным воздухом происходит, когда поверхность алюминия покрывается слоем оксида алюминия (Al2O3), который образуется при реакции алюминия с кислородом из воздуха. Оксид алюминия затем реагирует с водой, образуя гидроксид алюминия и выделяя еще больше водорода.
Реакция алюминия с влажным воздухом может быть описана следующим химическим уравнением:
| Алюминий (Al) | + | Кислород (O2) из воздуха | → | Оксид алюминия (Al2O3) | ||
| + | Вода (H2O) | → | Гидроксид алюминия (Al(OH)3) | + | Водород (H2) |
Взаимодействие с щелочами и кислотами

Алюминий активно взаимодействует с щелочами, такими как гидроксид натрия (NaOH) или гидроксид калия (KOH). При этом происходит образование алюминиевых гидроксидов Al(OH)3 или Al(OH)4-, а также выделение гидрогена:
2Al + 6NaOH → 2Na3AlO3 + 3H2↑
Следует отметить, что реакция с гидроксидами щелочных металлов протекает достаточно медленно и требует нагревания.
С другой стороны, алюминий не реагирует с обычными кислотами при комнатной температуре, такими как соляная кислота (HCl) или серная кислота (H2SO4). Это связано с образованием на поверхности алюминия оксидной пленки Al2O3, которая защищает металл от дальнейшего взаимодействия с кислотой. Однако, при нагревании или использовании более концентрированных кислот, реакция с алюминием может протекать:
2Al + 6HCl → 2AlCl3 + 3H2↑
Эта реакция сопровождается выделением водорода и образованием алюминиевого хлорида.
Важно отметить, что взаимодействие сильных оксо-соединений алюминия, таких как алюминаты или алюмо-кремнеземы веществ, а также сложных аминокислот и белков, происходит не только при повышенных температурах, но и при комнатной температуре. Это позволяет использовать алюминиевые соединения в различных сферах, включая медицину и промышленность.
Взаимодействие с серной кислотой и гидроксидом натрия

Алюминий обладает высокой химической активностью и способен вступать в реакции с различными веществами при комнатной температуре. Рассмотрим две таких реакции: взаимодействие алюминия с серной кислотой и алюминия с гидроксидом натрия.
При взаимодействии алюминия с серной кислотой, образуется соль и выделяется газ:
- Алюминий + серная кислота → соль + гидроген
- 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Серная кислота реагирует с поверхностью алюминия, образуя сульфат алюминия (Al2(SO4)3) и выделяя молекулярный водород (H2). Реакция сопровождается выделением тепла.
Взаимодействие алюминия с гидроксидом натрия приводит к образованию гидроксида алюминия и соли натрия:
- Алюминий + гидроксид натрия → гидроксид алюминия + соль натрия
- 2Al + 2NaOH → 2NaAlO2 + H2
При этой реакции алюминий образует нерастворимое вещество - гидроксид алюминия (Al(OH)3). Выделяется молекулярный водород (H2). Соль натрия (NaAlO2) остается растворенной в воде.
Взаимодействие с хлором и бромом

Алюминий может реагировать с хлором и бромом при комнатной температуре, образуя соответствующие галогениды. Реакция алюминия с хлором происходит по следующей схеме:
| Реакция | Уравнение |
|---|---|
| Взаимодействие алюминия с хлором | 2Al + 3Cl2 ⟶ 2AlCl3 |
В данной реакции каждый атом алюминия образует по две связи с хлором, что приводит к образованию желтого кристаллического вещества – хлорида алюминия. Реакция происходит с выделением большого количества тепла и может протекать взрывоопасно в присутствии некоторых катализаторов.
Взаимодействие алюминия с бромом происходит по аналогичному механизму:
| Реакция | Уравнение |
|---|---|
| Взаимодействие алюминия с бромом | 2Al + 3Br2 ⟶ 2AlBr3 |
В результате этой реакции образуется бромид алюминия, который также представляет собой кристаллическое вещество. Взаимодействие с бромом также сопровождается выделением большого количества тепла.
Реакция с некоторыми органическими соединениями
Алюминий проявляет реактивность при взаимодействии с некоторыми органическими соединениями. Отдельные органические соединения способны образовывать стабильные соединения с алюминием или гидридами этого металла. Ниже перечислены некоторые из таких соединений и реакций, которые они проявляют при комнатной температуре:
- Алюминоорганические соединения: Алюминий может образовывать стабильные комплексные соединения с органическими лигандами, такими как алкили, ароматические соединения и амины. Эти соединения могут использоваться в качестве промежуточных соединений в органическом синтезе или в качестве катализаторов для различных химических реакций.
- Реакция с ацетоном: При комнатной температуре алюминий реагирует с ацетоном, образуя ацетоалюминиевые комплексы. Эта реакция может привести к образованию белых кристаллов и газообразных продуктов.
- Реакция с галогенированными органическими соединениями: Алюминий может реагировать с соединениями, содержащими хлор, бром или йод в своей структуре. В результате этой реакции образуются алкиловые комплексы алюминия, которые могут быть использованы в химическом синтезе или применяться в качестве катализаторов.
- Реакция со спиртами: Алюминий может реагировать с различными спиртами, образуя алкоксиды алюминия. Эти соединения могут служить важными промежуточными соединениями в органическом синтезе или использоваться в качестве катализаторов различных реакций.
Реакции алюминия с органическими соединениями могут быть сложными и требуют определенных условий, таких как соотношение реагентов, температура и растворитель. Эти реакции являются активной областью исследования в органической химии и находят широкое применение в различных промышленных процессах и синтезе органических соединений.