Вода, безусловно, является одним из самых важных реагентов в органической химии. Она активно взаимодействует с различными органическими соединениями и играет ключевую роль во множестве реакций. Ее уникальные физические и химические свойства делают ее необходимым инструментом для многих органических синтезов и превращений.
В первую очередь, вода активно реагирует с соединениями, содержащими функциональные группы, которые содержат атомы кислорода или водорода. Она способна образовывать взаимодействия с алкенами, алканами, фенилами и другими классами соединений. Разнообразие реакций может варьироваться от простого гидратирования – при добавлении молекулы воды к изначально не растворимому органическому соединению – до масштабного превращения органических молекул в присутствии избытка воды.
Кроме того, вода может служить как растворителем для многих органических соединений. Это особенно важно для соединений, которые слабо растворимы в неполярных растворителях, таких как бензол или гексан. Растворение соединений в воде не только облегчает проведение различных реакций, но также позволяет проводить исследования органических соединений в растворе, чтобы более полно понять их свойства и поведение.
Свойства воды в органической химии

Прежде всего, вода обладает высокой растворимостью, что позволяет использовать ее в качестве растворителя для многих органических соединений. Благодаря этому свойству вода способна разрушать слабые связи в молекулах органических соединений, что является основой для многих химических реакций.
Кроме того, вода обладает высокой теплоемкостью, что делает ее эффективным теплоносителем во многих органических реакциях. Она способна поглощать и отдавать большие количества тепла без существенного изменения своей температуры. Это свойство воды позволяет контролировать условия проведения реакций и предотвращать перегрев или переохлаждение смесей.
Вода также обладает высокой плотностью, что делает ее универсальным средством для разделения органических соединений. Она используется в качестве отделительного слоя при выпаривании или экстракции органических веществ.
Известно, что вода образует межмолекулярные водородные связи, что существенно влияет на ее структуру и свойства. Эта особенность воды позволяет ей образовывать комплексы с органическими соединениями, что имеет большое значение в органической химии.
Растворимость веществ
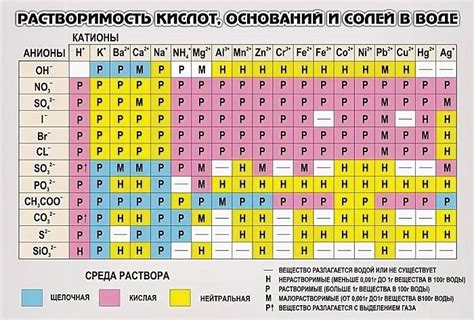
Многие органические вещества, такие как спирты, альдегиды, кетоны и некоторые кислоты, хорошо растворяются в воде. Полярные функциональные группы в этих соединениях позволяют им образовывать водородные связи с молекулами воды, что облегчает их растворение.
Однако, не все органические вещества имеют высокую растворимость в воде. Не полярные соединения, такие как масла, жиры и некоторые углеводороды, плохо растворимы в воде. Вода не может взаимодействовать с неполярными молекулами и ионами, поэтому они не растворяются в ней и образуют отдельные слои или частицы в смеси.
Вещества средней полярности могут быть частично растворены в воде благодаря присутствию обоих полярных и неполярных групп в их молекулах. Это позволяет им образовывать слабые взаимодействия с молекулами воды, но не полностью растворяться в ней. Такие соединения могут быть растворены в смеси воды с другими органическими растворителями.
Растворимость веществ в воде является важным фактором в органической химии, так как вода часто используется в реакциях и экспериментах. Знание о растворимости различных соединений позволяет ученым выбирать оптимальные условия для проведения реакций и получения желаемых продуктов.
Влияние на скорость химических реакций

Вода имеет существенное влияние на скорость химических реакций. Ее роль может быть как катализатором, ускоряющим химическую реакцию, так и реагентом, вступающим в химическую реакцию и изменяющим ее скорость. Ниже приведены основные факторы, определяющие влияние воды на скорость химических реакций:
- Растворение реагентов: Вода может растворять различные реагенты и образовывать ионы, которые могут участвовать в химической реакции. Растворенные вещества имеют более высокие скорости реакции, поскольку их частицы легче сталкиваются и взаимодействуют друг с другом.
- Ионизация: Вода имеет способность ионизироваться и образовывать ионы гидроксида (OH-) и ионы водорода (H+). Повышение концентрации ионов в водной среде может повысить скорость химических реакций, особенно для реакций, в которых требуется участие этих ионов.
- Диссоциация реагентов: Вода может способствовать диссоциации некоторых соединений на ионы, что облегчает процесс реакции.
- Регуляция температуры: Вода может служить хорошим теплоносителем, что позволяет контролировать и регулировать температуру реакций. Изменение температуры может значительно влиять на скорость химических процессов.
- Участие в реакциях гидратации: Некоторые органические соединения могут гидратироваться с участием воды в ходе реакции. Это может привести к изменению конформации и свойств молекулы, что влияет на ее реакционную способность и скорость реакции.
Вода является неотъемлемой частью многих химических реакций и играет важную роль в органической химии. Понимание влияния воды на скорость реакций помогает проводить исследования и оптимизировать процессы синтеза и превращения веществ.
Осуществление ацидо-базовых реакций

Гидролиз представляет собой процесс разложения соединения на ионы в результате взаимодействия с водой. Вода может принимать роль кислоты, в случае когда она отдает протон (H+) другому веществу, или щелочи, когда получает протон от другого вещества. Такие реакции называются амфотерными – вода может действовать и как кислота, и как основание.
Результатом ацидо-базовых реакций воды могут быть различные ионы, такие как гидроксидные (OH-) или оксониевые (H3O+). Гидроксидные ионы ОН- являются основаниями, а оксониевые ионы H3O+ – кислотами.
Осуществление ацидо-базовых реакций в воде возможно благодаря наличию в молекуле воды одной донорной и одной акцепторной пары электронов. Это обусловлено наличием одной связи O-H, где карбоновый атом – акцептор электронной плотности, а водородный атом – его донор.
| Реакция | Уравнение реакции | Пример |
|---|---|---|
| Сильное основание | M(OH)n + H2O → MOH (n-1)+ + OH- | NaOH + H2O → NaOH2+ + OH- |
| Слабое основание | B + H2O → BH+ + OH- | NH3 + H2O → NH4+ + OH- |
| Сильная кислота | HA + H2O → H3O+ + A- | HCl + H2O → H3O+ + Cl- |
| Слабая кислота | HA + H2O → H3O+ + A- | CH3COOH + H2O → H3O+ + CH3COO- |
Формирование водородных связей
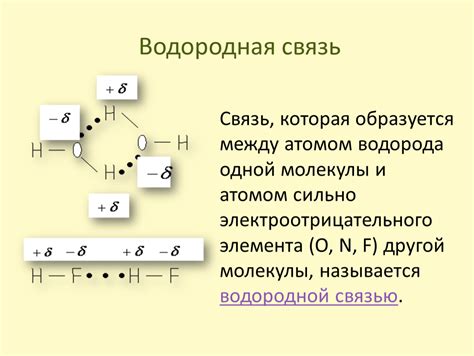
Водородная связь – это неравномерное разделение электронной плотности между водородом атома и соседней электроотрицательной частицей, такой как кислород или азот. В результате образуется электростатическое притяжение между двумя зарядами разного знака.
Формирование водородной связи особенно важно для молекул воды. Каждая молекула воды способна образовывать две водородные связи со соседними молекулами. В результате образуется структура, называемая водородными связанными сетями.
Эти водородные связи сильно влияют на физические и химические свойства воды. Они делают ее высококипучей, высоковязкой и обладающей высокой теплоемкостью. Они также отвечают за способность воды растворять многие органические и неорганические вещества.
Формирование водородных связей играет важную роль во многих органических реакциях. Вода может быть использована в качестве реагента или растворителя благодаря своей способности вступать во взаимодействие с органическими соединениями посредством образования водородных связей.
Таким образом, формирование водородных связей является ключевым аспектом взаимодействия воды с другими молекулами в органической химии и играет важную роль во многих жизненно важных процессах.
Разрыв и образование связей с органическими соединениями
Вода играет важную роль в органической химии, так как может участвовать в разрыве и образовании связей с органическими соединениями. Для наглядности и управления реакциями часто используется табличное представление реакционных соотношений.
| Реакция | Описание |
|---|---|
| Гидролиз | Разрыв связи с образованием двух новых молекул с помощью воды. Примером может служить разрушение эфиров с образованием алкоголя и карбоновой кислоты. |
| Гидратация | Образование связи с органическими соединениями путем присоединения воды. Примером может служить образование этилового спирта из этилена. |
| Образование воды | Процесс, в котором вода образуется в результате реакции между двумя органическими соединениями. Например, в результате реакции окисления алканов. |
Таким образом, вода может активно участвовать в реакциях с органическими соединениями, образуя новые вещества и приводя к изменению их свойств. Это делает ее важным реагентом в органической химии.
Амфотерные свойства

Амфотерные свойства воды проявляются, например, при взаимодействии с карбоновыми кислотами. В реакциях сильной кислоты с водой, в ней происходит катионный переход H+ от кислоты к молекуле воды. В реакциях органических оснований с водой, она действует в роли кислоты и отводит протон, образуя ион гидроксида. Вода также может действовать в роли катализатора или поддерживающего растворителя в органических реакциях.
Амфотерные свойства воды играют важную роль в биологических системах и химических реакциях органического синтеза. Без этих свойств вода не могла бы являться уникальным растворителем биологических молекул и не выполнять такие важные функции, как поддержание pH внутри клетки и участие в реакциях гидролиза и синтеза макромолекул.
| Вода | Карбоновые кислоты | Органические основания |
|---|---|---|
| H2O | R-COOH | R-NH2 |
| H+ | Берет H+ | Отдает H+ |
| OH- | Образует OH- | Не взаимодействует |



