Оксиды и гидроксиды - это два основных типа химических соединений, которые являются частями более широкой группы веществ, известных как неорганические соединения. Оксиды состоят из кислорода и одного или нескольких других элементов, в то время как гидроксиды содержат один или несколько атомов водорода в сочетании с одним или несколькими металлами.
Одно из основных отличий между оксидами и гидроксидами заключается в том, как они взаимодействуют с водой. Оксиды могут быть растворены в воде, образуя растворы, которые могут быть как кислотными, так и щелочными. Гидроксиды, с другой стороны, образуют растворы, которые являются щелочными.
Еще одно отличие между оксидами и гидроксидами заключается в их химических свойствах. Оксиды, в зависимости от типа, могут быть окисленными или восстановленными в реакциях. Гидроксиды же чаще всего используются в качестве основы или источника гидроксидного иона (OH-), который играет важную роль в многих химических реакциях.
Оксиды и гидроксиды: основные отличия
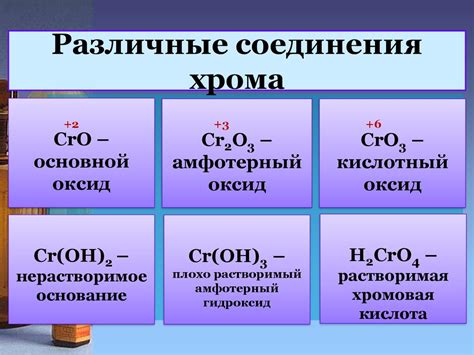
Оксиды представляют собой соединения, состоящие из атомов кислорода и других элементов. Они образуются в результате реакции кислорода с другими элементами. Гидроксиды, с другой стороны, состоят из металлического ионного компонента и одного или нескольких гидроксильных групп (OH-). Они образуются, когда металл реагирует с водой.
Одно из основных отличий между оксидами и гидроксидами заключается в их реактивности. Оксиды обычно являются более реактивными и способны реагировать с кислотами, образуя соли и воду. Некоторые оксиды также могут реагировать с веществами и быстро окислять их. Гидроксиды, с другой стороны, обычно менее реактивны и реагируют с кислотами, образуя соли и воду.
Еще одним отличием между оксидами и гидроксидами является их физическое состояние. Оксиды могут существовать в различных формах, включая газы (например, оксид азота), жидкости (например, оксид серы) и твердые вещества (например, оксид железа). Гидроксиды, с другой стороны, обычно существуют в виде твердых веществ.
Важным отличием между оксидами и гидроксидами является их использование. Оксиды широко применяются в различных отраслях, включая металлургию, стекловарение и электронику. Гидроксиды также имеют свои применения, особенно в производстве щелочей, электролитов и препаратов для лечения кожных заболеваний.
Таким образом, оксиды и гидроксиды обладают различными свойствами и структурами, что делает их уникальными классами химических соединений. Понимание их основных отличий является важным для понимания их роли и применения в различных областях науки и технологии.
Состав и структура
Оксиды и гидроксиды представляют собой химические соединения, состоящие из атомов кислорода и элемента, с которым кислород связан. Однако их атомная структура и распределение зарядов отличаются.
Оксиды, как правило, состоят из одного атома кислорода и другого химического элемента. Атомы кислорода и элемента соединяются с помощью ковалентной связи или связи ионного типа, что зависит от электроотрицательности атомов. Оксиды могут формировать различные кристаллические структуры, такие как ионная, молекулярная или сетчатая.
Гидроксиды, в отличие от оксидов, содержат кислород и группу гидроксиль (OH). Кристаллическая структура гидроксидов обычно представляет собой ионную решётку, в которой атомы катиона связаны с атомами аниона через ионообменные связи. Гидроксиды образуются в результате реакции между металлом и водой, или между металлом и гидроксидной кислотой.
Таким образом, состав и структура оксидов и гидроксидов определяются наличием и расположением атомов кислорода и других химических элементов. Эти различия в составе и структуре приводят к различным свойствам и реакционной активности этих соединений.
Реакции с водой

Оксиды и гидроксиды могут проявлять разные свойства при контакте с водой.
Оксиды, будучи соединениями элемента с кислородом, реагируют с водой, образуя кислотные оксиды. При этом происходит окисление элемента. Например, натрий (Na) реагирует с водой, образуя кислоту натриевую (NaOH) и выделяя водород (H₂).
Гидроксиды, в свою очередь, реагируют с водой, образуя щелочные растворы. Например, гидроксид натрия (NaOH) растворяется в воде, образуя щелочную среду и выделяя тепло.
Важно отметить, что гидроксиды обычно имеют высокую растворимость в воде, в то время как оксиды могут быть малорастворимыми или нерастворимыми.
Химические свойства и реакции

Оксиды и гидроксиды обладают разными химическими свойствами и подвергаются различным реакциям.
Оксиды, будучи соединениями химических элементов с кислородом, образуют кислоты при взаимодействии со водой. Также оксиды активно взаимодействуют с кислородом, образуя пероксиды и другие окислы. Примером такой реакции может служить взаимодействие алюминия с кислородом при нагревании, после которого образуется алюминиевый оксид (Al2O3). Оксиды также могут быть окислителями или восстановителями в различных реакциях.
Гидроксиды, с другой стороны, реагируют с кислотами, образуя соли и воду. Например, гидроксид натрия (NaOH) реагирует с соляной кислотой (HCl) и образует соль хлорида натрия (NaCl) и воду. Гидроксиды могут также реагировать с другими соединениями, например, солями, и образовывать осадки или гидраты.
Кроме того, оксиды и гидроксиды могут претерпевать реакции восстановления или окисления при взаимодействии с другими веществами. Оксиды часто используются в качестве катализаторов в различных химических процессах. Гидроксиды, в свою очередь, находят применение в производстве мыла, стекла, удобрений и других продуктов.
Физические свойства

Физические свойства оксидов и гидроксидов существенно различаются и определяются структурой и составом данных соединений.
Оксиды представляют собой химические соединения, состоящие из металла и кислорода. Они обычно имеют прочную кристаллическую структуру и могут быть в виде твердых, жидких или газообразных веществ. Некоторые оксиды имеют высокую температуру плавления и кипения, такие, например, как оксиды кремния и железа. Другие оксиды, включая оксиды металлов, могут быть твердыми и хрупкими.
Гидроксиды, с другой стороны, представляют собой соединения, состоящие из металла, кислорода и водорода. Они обычно имеют щелочную или основную природу и демонстрируют слабощелочные свойства. Гидроксиды зачастую принимают вид твердых, кристаллических веществ с высокой температурой плавления, таких, как гидроксид натрия. Они могут быть и в виде растворов, обладающих щелочными свойствами, таких, как щелочи.
Таким образом, физические свойства оксидов и гидроксидов различаются в зависимости от их состава, структуры и взаимодействия с другими веществами.
Использование в промышленности

Оксиды и гидроксиды широко используются в промышленности благодаря своим уникальным свойствам и химической активности.
Оксиды используются в производстве стекла, керамики, электроники и многих других отраслях промышленности. Например, оксид кремния (SiO2) применяется для производства стекла, керамики и солнечных батарей. Оксид железа (Fe2O3) используется в производстве красок, пигментов и магнитных материалов.
Гидроксиды также имеют широкое применение в различных отраслях промышленности. Гидроксид натрия (NaOH), также известный как щелочь, используется в производстве мыла, бумаги, стекла и алюминия. Гидроксид кальция (Ca(OH)2), известный как навозный камень или гашеная известь, применяется в строительстве, помолах, водоочистке и других процессах.
Оксиды и гидроксиды универсальны и находят применение в различных областях промышленности, внося важный вклад в производство многих материалов и товаров.
Встречаемость в природе

Оксиды встречаются как в неживой природе, так и в организмах живых существ. Например, оксиды таких элементов, как кислород, железо, алюминий и титан, составляют значительную часть земной коры. Кислородный оксид (диоксид кремния) является основным компонентом песчаников, а оксид железа (оксид железа III) придает красный цвет большинству глин. Многие оксиды играют важную роль как катализаторы в химических реакциях, например, оксид железа IV используется в процессе производства аммиака.
Гидроксиды также широко распространены в природе. Например, гидроксид железа (гидроксид железа III), известный как ржавчина, образуется в результате окисления железа влагой из окружающей среды. Гидроксид алюминия (гидроксид алюминия III) встречается в виде минерала гиббсит, который используется в производстве алюминия. Гидроксиды также находят применение в медицине и косметике благодаря своим лечебным и увлажняющим свойствам.
Кроме того, оксиды и гидроксиды являются продуктами химических реакций, происходящих в природных системах. Например, оксиды азота образуются в результате сгорания топлива в автомобильных двигателях и являются одной из причин загрязнения атмосферы. Гидроксиды также образуются в результате химической реакции между влагой и различными веществами, например, алкалиями и галогенами.
Влияние на окружающую среду

Оксиды образуются при соединении кислорода с другими химическими элементами. Они могут являться компонентами вредных выбросов, таких как диоксид серы (SO2), диоксид азота (NO2) и другие. При выбросах оксидов в атмосферу они могут вызывать загрязнение воздуха и атмосферного осадка, что отрицательно сказывается на здоровье человека и окружающей среды.
Гидроксиды, в свою очередь, являются основаниями и могут вступать в реакции с кислотами. Они способны влиять на pH водных систем и почвы. Сильные гидроксиды, такие как натриевый и гидроксид калия, могут оказывать разрушительное действие на биологический разнообразие в водных системах и почве. Они могут вызывать изменение цвета воды, нарушение роста и развития микроорганизмов и растений, а также негативное влияние на животных и рыб.
Из-за влияния оксидов и гидроксидов на окружающую среду, их выбросы и пользование должны строго контролироваться и соблюдаться соответствующие нормы и стандарты. Это важно для сохранения экологического равновесия и предотвращения загрязнения окружающей среды и ущерба здоровью людей и животных.
Здоровье и безопасность при работе с оксидами и гидроксидами

При работе с оксидами и гидроксидами необходимо соблюдать определенные меры предосторожности для обеспечения здоровья и безопасности. Они могут быть опасными при попадании на кожу, в дыхательные пути или пищеварительную систему.
Во-первых, при работе с оксидами и гидроксидами необходимо надевать защитное снаряжение, включающее в себя халат, перчатки и защитные очки. Это поможет предотвратить попадание вещества на кожу или в глаза.
Во-вторых, при работе с оксидами и гидроксидами необходимо обеспечить хорошую вентиляцию помещения. Оксиды и гидроксиды могут выделять вредные газы или пары, поэтому важно иметь возможность удалить их из рабочей зоны.
В-третьих, при работе с оксидами и гидроксидами необходимо избегать контакта с кожей и слизистыми. Если возникло попадание вещества на кожу, следует тщательно промыть затронутую область водой в течение нескольких минут.
В-четвертых, при работе с оксидами и гидроксидами необходимо избегать вдыхания паров или пыли оксидов и гидроксидов. Если необходимо работать в условиях, где есть риск вдыхания газов или паров, следует надеть респиратор.
В-пятых, при работе с оксидами и гидроксидами необходимо обеспечить безопасное хранение этих веществ. Они должны быть хранены в специальных контейнерах, подходящих для хранения опасных веществ.
Все эти меры помогут обеспечить безопасность и предотвратить возможные вредные последствия при работе с оксидами и гидроксидами. Соблюдение правил безопасности при работе с химическими веществами является важным аспектом заботы о здоровье.