Изотермический процесс является одним из важных понятий в физике и химии, описывающим изменение состояния газа при постоянной температуре. Он является ключевым для понимания специфических свойств газа и его поведения в различных условиях.
В изотермическом процессе температура газа остается постоянной, что означает, что энергия газа не меняется со временем. Но это не означает, что ничего не происходит с газом. Вместо этого, в изотермическом процессе происходит изменение других физических параметров газа, таких как давление и объем.
При увеличении объема газа в изотермическом процессе его давление уменьшается. Это объясняется тем, что если газ расширяется при постоянной температуре, энергия молекул газа распределяется более равномерно, что приводит к увеличению среднеградовой скорости молекул и, как следствие, к увеличению давления. Таким образом, чтобы сохранить постоянную температуру, газа должен расшириться, чтобы снизить его среднюю скорость молекул и сопоставить ее сначала.
На самом деле, изотермический процесс имеет множество применений. Он используется в таких областях, как промышленность, медицина и научные исследования. Благодаря своей уникальной природе, изотермический процесс является важным инструментом для понимания и управления поведением газа в различных ситуациях и создания новых технологий и материалов.
Изотермический процесс: особенности и свойства

Особенностью изотермического процесса является то, что он происходит при постоянной температуре. Это означает, что количество теплоты, получаемой или отдаваемой газом в процессе, равно количеству работы, совершаемой над или над газом.
При изотермическом расширении газа он поглощает теплоту из окружающей среды, что позволяет ему совершить работу. При изотермическом сжатии газ отдаёт теплоту окружающей среде.
Свойством изотермического процесса является то, что между давлением и объёмом газа существует обратная пропорциональность. По закону Бойля-Мариотта, для изотермического процесса давление газа обратно пропорционально его объёму. То есть, при увеличении объёма газа, его давление уменьшается, и наоборот.
Этот закон обусловлен тем, что при изотермическом процессе газ совершает работу за счёт кинетической энергии его молекул. Увеличение объёма газа приводит к большему количеству молекул, участвующих в совершении работы, и, следовательно, к уменьшению давления.
Изотермический процесс имеет важное практическое применение. Например, его используют в тепловых машинах, таких как паровые и газовые турбины. В таких машинах горячий рабочий газ расширяется (или сжимается) изотермически, совершая работу.
Как изменяется газ в изотермическом процессе
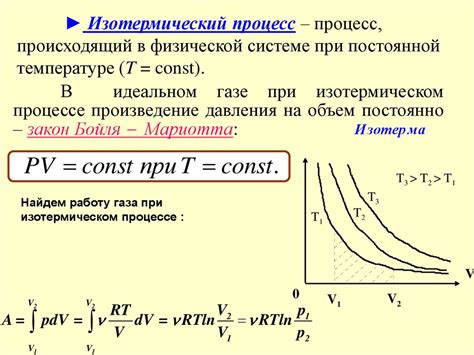
Газ в изотермическом процессе изменяется под действием внешних факторов, таких как изменение давления или объема. При увеличении давления газ сжимается, а при увеличении объема газ расширяется. Важно отметить, что в изотермическом процессе изменение объема и давления связано между собой по закону Бойля-Мариотта.
Согласно закону Бойля-Мариотта, при изотермическом процессе объем газа и давление обратно пропорциональны: P1 * V1 = P2 * V2, где P1 и V1 – изначальное давление и объем газа, P2 и V2 – итоговое давление и объем газа.
Таким образом, в изотермическом процессе газ изменяет свой объем и давление, при этом сохраняя постоянную температуру. Этот процесс может быть использован для выполнения работы, например, при работе поршневых двигателей или воздушных компрессоров.
Законы, регулирующие идеальный газ
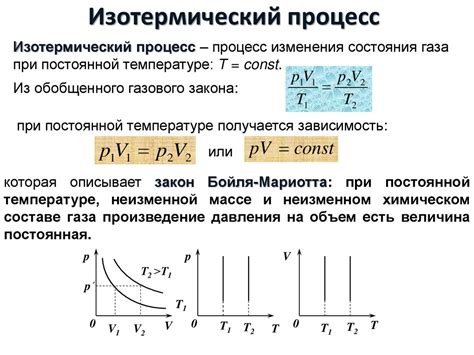
1. Закон Бойля-Мариотта (закон давления)
Закон Бойля-Мариотта устанавливает, что при постоянной температуре объем идеального газа обратно пропорционален его давлению. Из математической точки зрения, это можно записать следующим образом:
P1*V1 = P2*V2
где P1 и P2 - начальное и конечное давления газа,
V1 и V2 - начальный и конечный объемы газа.
2. Закон Шарля (закон Гей-Люссака)
Закон Шарля связывает объем газа и его температуру при постоянном давлении. Закон формулируется следующим образом:
V1/T1 = V2/T2
где T1 и T2 - начальная и конечная температуры газа,
V1 и V2 - начальный и конечный объемы газа.
3. Закон Гей-Люссака (закон давления и температуры)
Закон Гей-Люссака устанавливает, что при постоянном объеме идеального газа давление и температура прямо пропорциональны. Закон записывается следующим образом:
P1/T1 = P2/T2
где T1 и T2 - начальная и конечная температуры газа,
P1 и P2 - начальное и конечное давления газа.
Эти три закона, в совокупности с уравнением состояния идеального газа, описывают и предсказывают поведение газов в различных условиях.
Термодинамические параметры в изотермическом процессе

В изотермическом процессе, происходит изменение объема газа при постоянной температуре. Согласно закону Бойля-Мариотта, давление и объем газа являются обратно пропорциональными величинами: P * V = const, где P - давление, V - объем. Поэтому, если объем газа увеличивается, его давление будет уменьшаться, и наоборот.
Еще одним важным параметром в изотермическом процессе является количество вещества газа, измеряемое в молях. По закону Гей-Люссака, отношение давления к количеству вещества является постоянной величиной при постоянной температуре и объеме: P / n = const, где n - количество вещества.
Таким образом, в изотермическом процессе изменение давления газа будет пропорционально изменению его объема, а отношение давления к количеству вещества будет оставаться неизменным. Эти параметры играют важную роль в понимании и описании поведения газов в изотермических условиях.
Влияние давления на газ в изотермическом процессе

Влияние давления на газ в изотермическом процессе связано с законом Бойля-Мариотта, который утверждает, что при постоянной температуре объем газа обратно пропорционален его давлению. Другими словами, при увеличении давления на газ, его объем уменьшается, а при уменьшении давления – увеличивается.
При изотермическом расширении газа под действием внешнего давления, тепло, выделяемое в процессе совершения работы, поступает из окружающей среды в газ. Это позволяет сохранять постоянную температуру газа в процессе расширения.
Изменение давления на газ в изотермическом процессе может приводить к изменению его физических свойств, таких как плотность, вязкость и проницаемость. Под воздействием давления могут происходить фазовые переходы, например, переход газа в жидкость или твердое состояние.
Влияние давления на газ в изотермическом процессе имеет практическое применение в различных областях. Например, в промышленности может использоваться для сжатия газов с целью увеличения их плотности и улучшения транспортабельности. В научных исследованиях влияние давления на газ может использоваться для изучения его свойств и поведения в различных условиях.
- Закон Бойля-Мариотта утверждает, что при постоянной температуре объем газа обратно пропорционален его давлению.
- При изотермическом расширении газа под действием внешнего давления, тепло поступает из окружающей среды в газ.
- Изменение давления на газ в изотермическом процессе может приводить к изменению его физических свойств и фазовым переходам.
- Влияние давления на газ в изотермическом процессе имеет практическое применение в промышленности и научных исследованиях.
Работа и теплота при изотермическом процессе
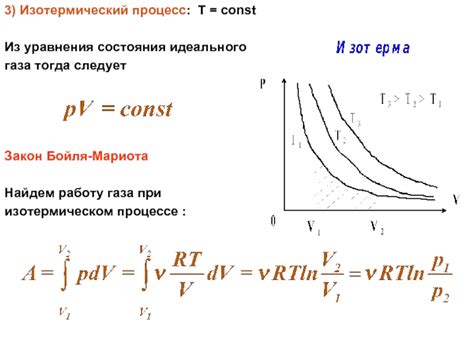
Работа, совершаемая газом в изотермическом процессе, определяется по формуле:
А = nRT ln(Vконечный/Vначальный)
где:
- A – работа, совершенная газом
- n – количество вещества газа
- R – универсальная газовая постоянная
- T – температура газа
- Vконечный – объем газа после изменения состояния
- Vначальный – объем газа до изменения состояния
Теплота, передаваемая или получаемая в изотермическом процессе, определяется по формуле:
Q = A
Таким образом, в изотермическом процессе работа, совершаемая газом, равна теплоте, передаваемой или получаемой им. Это связано с тем, что при постоянной температуре внутренняя энергия газа не изменяется, и вся полученная или отданная энергия превращается в работу или теплоту.
Изотермический процесс широко используется в различных областях, таких как промышленность, химия и термодинамика. Понимание работы и теплоты при изотермическом процессе является важным аспектом для изучения и применения данного процесса.
Применение изотермического процесса в технике

Изотермический процесс, при котором температура газа остается постоянной, находит широкое применение в различных технических областях. Вот некоторые из них:
- Компрессоры и насосы: изотермический процесс используется для сжатия газов и жидкостей. За счет постоянной температуры происходит более эффективное сжатие без значительного увеличения тепловыделения.
- Холодильные и морозильные установки: технология основана на изотермическом процессе охлаждения и замораживания. Газ в холодильнике или морозильнике сжимается и расширяется, при этом поддерживается постоянная температура.
- Теплообменные аппараты: изотермический процесс позволяет эффективно передавать тепло между различными средами. Например, воздух может быть сжат и нагрет до высокой температуры, а затем передан этот тепловой энергией в другую среду.
- Системы кондиционирования и вентиляции: изотермический процесс используется для охлаждения или нагревания воздуха в помещении. Благодаря постоянной температуре, достигается стабильное и комфортное климатическое условие.
- Газовые и жидкостные пылеуловители: при использовании изотермического процесса осуществляется сбор пыли и загрязняющих частиц из воздуха или газа. Газ проходит через фильтр, где температура поддерживается постоянной, и загрязнения остаются на поверхности фильтра.
Это только некоторые примеры применения изотермического процесса в технике. Важно отметить его значимость в энергетике, промышленности и бытовых устройствах. Изучение и использование этого процесса позволяет улучшить эффективность и качество различных технических систем.