Протон - это небольшая частица, являющаяся одним из фундаментальных вещественных частиц в физике элементарных частиц. Протон обладает положительным электрическим зарядом и находится в составе атомных ядер. Он является одним из компонентов атомного ядра, вместе с нейтронами.
Протоны имеют массу приблизительно равную массе нейтрона и состоят из двух вида кварков - верхнего и нижнего. Протоны называются "кварконами", так как они являются стабильными композитными частицами. Кроме того, протоны являются основной составной частью атомных ядер, и их количество определяет химические свойства атома.
Протоны взаимодействуют друг с другом и с другими частицами посредством электромагнитной силы. Эта сила позволяет протонам образовывать различные структуры и конфигурации, определяющие свойства вещества и его поведение в дальнейшем. Протоны также участвуют в реакциях ядерного распада и ядерных синтезов.
Весьма интересно, что в результате соударения протонов с высокой энергией могут образовываться другие элементарные частицы, такие как пионы, мезоны или каоны. Протон является неотъемлемой частью нашего мира и играет важную роль в изучении основных законов физики.
История открытия протона
В 1869 году немецкий физик Йозеф Джон Томсон в ходе эксперимента с катодными лучами обнаружил присутствие заряженных частиц внутри атомов. Он предположил, что эти частицы называются корпускулами или электронами. Однако, Томсон не смог определить массу этих частиц.
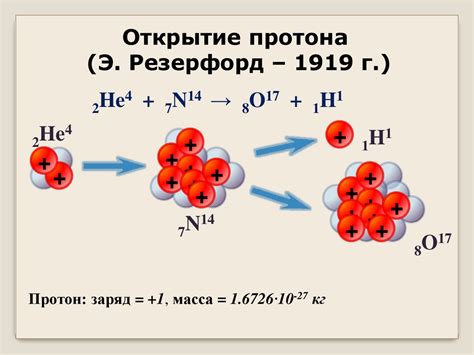
Дальнейшие исследования проводились другими учеными. В 1919 году английский физик Эрнест Резерфорд в ходе эксперимента с альфа-частицами и тонкой золотой фольгой смог определить, что в центре атома находится заряженная и очень тяжелая частица. Он предположил, что эта частица называется протоном. Резерфорд также установил, что протон имеет положительный заряд.
Окончательное подтверждение открытия протона было получено в 1932 году. Американский физик Джеймс Чедвик совместно со своими коллегами обнаружил существование нейтрона. После этого, стало ясно, что протоны и нейтроны составляют ядро атома.
В итоге, история открытия протона связана с трудами множества ученых и серией экспериментов, благодаря которым стало возможным понять строение атомного ядра и роль протонов в нем.
Первые теории об атоме
Теория Демокрита имела значительное влияние на развитие атомистической концепции. В XIX веке эта концепция стала научной теорией, основанной на экспериментальных данных. Она была развита учеными Джоном Дальтоном и Авогадро.
Джон Дальтон разработал теорию атомного строения в начале XIX века. Согласно его теории, атомы являются неделимыми и непроницаемыми частицами, соединяющиеся между собой в определенных пропорциях. Различные типы атомов образуют различные элементы, а соединение атомов разных элементов создает различные соединения. Дальтон также разработал законы сохранения вещества и газов.
Амадео Авогадро внес важный вклад в развитие теории атомов, сформулировав гипотезу о равных объемах газов и числе частиц в них. Он предположил, что один и тот же объем газа при одинаковой температуре и давлении будет содержать одинаковое число молекул. Это позволило объяснить закон Гей-Люссака о сочетаемости газов и объяснить взаимосвязь между объемом и числом частиц в газе.
Теории Демокрита, Дальтона и Авогадро позволили ученым более точно представить атом как основную единицу материи. Это открытие открыло путь к дальнейшему развитию науки и раскрытию тайн атомной структуры.
Эксперименты Чадвика и Гольдштейна

В начале XX века физики Эрнест Резерфорд, Генри Мозли и Ханс Гайзенберг предложили модель атома, в которой положительно заряженное ядро окружено облаком отрицательно заряженных электронов. Однако, не было экспериментальных данных, подтверждающих эту модель.
Стивен Чадвик и Ганс Гольдштейн провели ряд экспериментов, чтобы проверить модель атома, представленную Резерфордом и его коллегами. Они использовали специальное устройство, известное как трубка с катодным лучом, которое позволяло исследовать поведение заряженных частиц в электрическом поле.
Во время эксперимента Чадвик и Гольдштейн направили поток атомных частиц на тонкую мишень из фольги. При этом они обнаружили, что некоторые частицы отклонялись в разные стороны, а некоторые даже возвращались назад к исходному источнику. Это показало, что атомы содержат очень маленькое, но очень плотное ядро, в котором находится положительно заряженная частица - протон.
Эксперименты Чадвика и Гольдштейна подтвердили модель атома, предложенную Резерфордом, и помогли установить, что протон является основной составной частью ядра атома. Это открытие имело огромное значение для развития физики и дало новое понимание структуры атома.
Структура протона
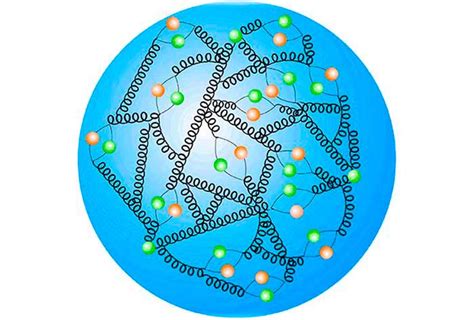
Протон состоит из трех кварков: двух «верхних» кварков (u) и одного «нижнего» кварка (d). Кварки – это элементарные частицы, нейтроны и протоны построены из них. Два кварка типа «верхний» дают положительный заряд, а кварк типа «нижний» дает отрицательный заряд. Такая комбинация кварков в протоне придает ему положительный заряд.
Помимо кварков, протон также содержит поле скалярного бозона Хиггса, которое играет важную роль в протонной структуре. Это поле даёт массу протону и позволяет ему участвовать в слабом взаимодействии. Протон также обладает спином, равным 1/2 в единицах светового кванта.
Модель Резерфорда и проблемы

Модель Резерфорда, предложенная в 1911 году нью-зеландским физиком Эрнестом Резерфордом, была первой успешной попыткой объяснить строение атома. Согласно этой модели, атом представлял собой небольшое и плотное ядро, вокруг которого двигались электроны на разных уровнях энергии.
Однако, несмотря на успех модели Резерфорда, она столкнулась с некоторыми проблемами. Одной из главных проблем была неспособность модели объяснить стабильность атома. Согласно законам электродинамики, электроны, двигаясь по орбитам с ускорением, должны были непрерывно излучать энергию и терять свою кинетическую энергию. Следовательно, атом должен был бы быстро разрушиться.
Существовала также проблема с расположением электронов. Согласно модели Резерфорда, электроны должны были двигаться вокруг ядра на круговых орбитах. Однако, движение электронов по круговым орбитам противоречило законам электромагнетизма, поскольку электроны, при движении по криволинейной траектории, должны испускать электромагнитное излучение.
На основе этих и других проблем, модель Резерфорда была дополнена и усовершенствована в последующие годы различными учеными, включая Нильса Бора и Эрвина Шредингера. Эти усовершенствования привели к разработке квантовой механики, которая адекватно описывает поведение атомов и более позднее была принята как основа современной физики.
Эксперименты Резерфорда и Бора
Эксперименты Резерфорда и Бора были майлстоунами в исследовании строения атома и помогли формированию новой модели атома, которая объясняла наблюдаемые явления.
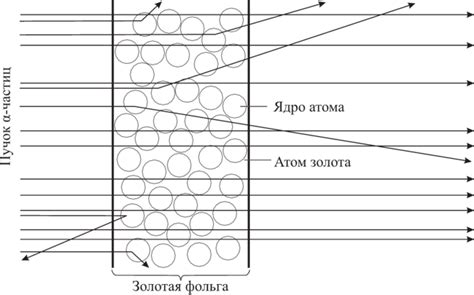
Эксперимент Резерфорда был проведен в 1911 году. Резерфорд облучал тонкую пластинку золота альфа-частицами и наблюдал их рассеяние. Он ожидал, что альфа-частицы будут проходить сквозь золотую пластинку без значительного отклонения, так как атомы считались преимущественно пустотой. Однако, наблюдения Резерфорда показали, что часть альфа-частиц отклонялась на большие углы и даже возвращалась назад. Это было непредсказуемым и несогласующимся с тогдашней моделью атома.
В 1913 году Бор предложил свою модель атома, основанную на эксперименте Резерфорда. По Бору, атом состоит из положительно заряженного ядра, вокруг которого электроны обращаются на определенных энергетических уровнях. Атом становится стабильным, когда электроны находятся на своих энергетических уровнях и не двигаются. Переход электрона с одного энергетического уровня на другой сопровождается испусканием или поглощением кванта энергии.
Модель Бора успешно объясняла наблюдения Резерфорда: отклонение альфа-частиц было результатом их взаимодействия с положительно заряженным ядром атома. Модель также объясняла линейчатый спектр атома водорода, который был известен задолго до эксперимента Резерфорда.
Эксперименты Резерфорда и Бора были первыми шагами на пути к пониманию строения атома, их результаты положили основу для дальнейших исследований и разработку современной квантовой механики.
Свойства протона
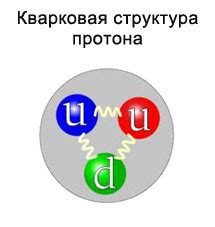
1. Элементарный электрический заряд. Протон имеет положительный заряд, равный элементарному заряду и обозначается символом "e". Заряд протона составляет +1 единицу элементарного заряда.
2. Масса. Масса протона равна примерно 1,6726219 × 10^-27 килограмма. Это примерно 1836 раз масса электрона, что делает протон существенно более массивным частицей.
3. Нейтральность внутренних зарядов. Внутри протона находятся кварки, которые обладают зарядом, но в целом протон является электрически нейтральной частицей.
4. Взаимодействие с другими частицами. Протоны обладают электрическим зарядом и, следовательно, взаимодействуют с другими заряженными частицами, такими как электроны. Протоны также притягивают друг друга силой ядерного взаимодействия.
Эти свойства протона играют важную роль в физике и химии, определяя структуру и свойства атомов и молекул. Исследование и понимание протона является основой для понимания атомной и ядерной физики.
Масса и заряд протона
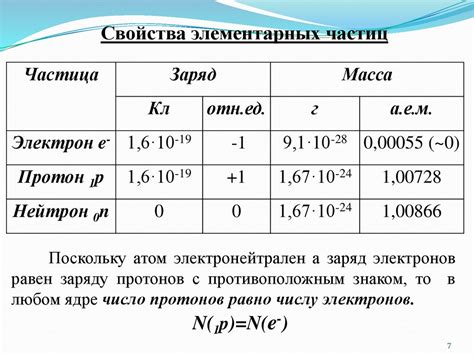
Масса протона составляет приблизительно 1.67 × 10^-27 килограмм или 1.67 × 10^-24 грамма. Это значит, что масса протона находится примерно в 1836 раз больше массы электрона, который является другой элементарной частицей атома.
Масса и заряд протона играют важную роль в физике и химии, так как определяют свойства атомов и их взаимодействие друг с другом. Использование знаний о протоне помогает понимать структуру вещества и различные физические процессы, происходящие на микроуровне.