Растворение спирта в воде - это процесс, в результате которого молекулы спирта равномерно распределяются в молекулярной сетке воды. Спирты считаются полярными молекулами, что значит, что они содержат полярные связи, обусловленные разностью электроотрицательности атомов.
Спирт может быть водородосодержащим, например, этанол (этиловый спирт) или пропанол (изопропиловый спирт), и иметь способность взаимодействовать с водой. Когда спирт добавляется в воду, молекулы воды окружают молекулы спирта, образуя водородные связи между атомами воды и спирта.
Вода представляет собой превосходный растворитель благодаря ее полярности, а спирт находится в числе веществ, которые легко растворяются в воде. Распределение молекул спирта в воде происходит благодаря двум факторам: поларности спирта и межмолекулярным силам притяжения. Молекулы спирта образуют связи с молекулами воды, а молекулы воды образуют связи с молекулами спирта. Это позволяет спирту полностью раствориться в воде.
Растворение спирта в воде: процесс и свойства

Сначала молекулы спирта разделяются на ионы или полюсные группы, поскольку они больше взаимодействуют с водой. Затем эти молекулы распределяются равномерно в растворе. Уже на втором этапе происходит образование водородных связей между молекулами воды и группами гидроксила (OH) в спирте. Это взаимодействие позволяет образовывать однородный раствор.
Растворение спирта в воде сопровождается изменением некоторых свойств воды, таких как температура кипения, вязкость и поверхностное натяжение. Спирт вносит воду в раствор таким образом, что температура кипения снижается, а вязкость и поверхностное натяжение увеличиваются. Эти изменения связаны с созданием дополнительных межмолекулярных взаимодействий между молекулами спирта и воды.
Важно отметить, что при растворении спирта в воде происходит также поглощение или выделение тепла, что может изменять температуру окружающей среды. Это является причиной ощущения холода при использовании спирта для охлаждения жидкостей.
Растворение спирта в воде может быть полезным в различных областях, таких как медицина, химия и кулинария. Например, этот процесс используется для изготовления антисептиков и других медицинских препаратов. Также спиртные растворы используются в пищевой промышленности для приготовления различных напитков и добавок.
Общие сведения о растворении спирта в воде
При растворении спирта в воде происходит образование водно-спиртового раствора, который может иметь различную концентрацию. Концентрация раствора определяется соотношением массы спирта к массе воды.
Спирты могут быть как летучими, так и нелетучими. Летучие спирты, такие как этанол (спирт этиловый), моментально растворяются в воде за счет образования водородных связей между молекулами спирта и воды. Нелетучие спирты, например, глицерин, растворяются в воде медленнее и требуют большего времени для достижения равновесного состояния раствора.
Растворение спирта в воде сопровождается выделением или поглощением тепла в зависимости от химического состава спирта и концентрации раствора. Некоторые спирты, например, метанол, выделяют тепло при растворении, в то время как другие, например, этанол, поглощают тепло.
| Название спирта | Химическая формула | Температура плавления, °С | Температура кипения, °С |
|---|---|---|---|
| Метанол | CH₃OH | -97,6 | 64,7 |
| Этанол | C₂H₅OH | -114,1 | 78,4 |
| Пропанол-1 | C₃H₇OH | -126,7 | 97,2 |
| Глицерин | C₃H₈O₃ | 18,2 | 290 |
При растворении спирта в воде, процесс диссоциации, то есть разделения молекул на ионы, не происходит. Водно-спиртовый раствор образуется за счет образования слабых промежуточных связей между молекулами спирта и воды, что позволяет им существовать вместе в едином растворе без разделения на ионы.
Физические процессы при растворении спирта в воде
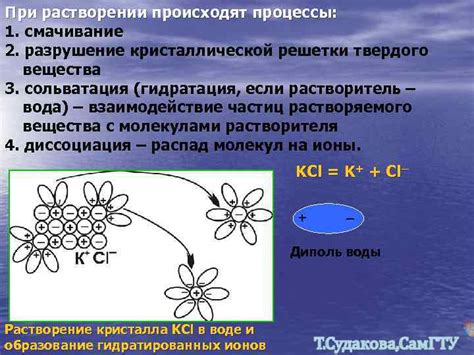
Первым процессом является диссоциация молекул спирта и воды. При смешении жидкостей между молекулами воды и спирта возникают взаимодействия, которые приводят к образованию новых соединений. Молекулы спирта разделяются на положительно и отрицательно заряженные и становятся частично растворенными водными молекулами.
Вторым процессом является образование водородных связей между молекулами спирта и воды. Водородные связи образуются между положительно заряженным водородом и отрицательно заряженным кислородом, что приводит к укреплению структуры раствора и созданию стабильной смеси.
Кроме того, наблюдается и процесс диффузии, при котором молекулы спирта перемещаются из области с более высокой концентрацией в область с более низкой концентрацией. Диффузия способствует равномерному распределению спирта в воде и облегчает процесс растворения.
Тепловые эффекты при растворении спирта в воде
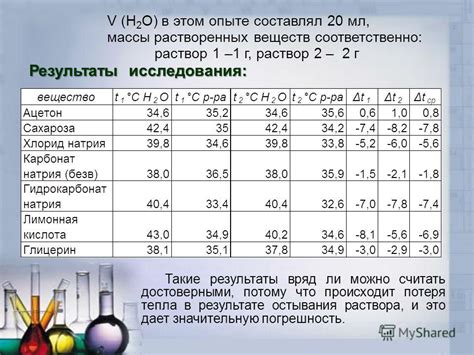
Растворение спирта в воде приводит к определенным тепловым эффектам. Этот процесс сопровождается поглощением или выделением тепла, в зависимости от соотношения спирта и воды.
Когда спирт добавляется в воду, происходит образование межмолекулярных взаимодействий между атомами воды и спирта. При этом, некоторые межмолекулярные связи в воде разрываются, требуя энергии. Это приводит к поглощению тепла из окружающей среды и вызывает эндотермическую реакцию.
Тепловое поглощение при растворении спирта в воде может быть ощутимым. Если при изначальном равновесии температура смеси была ниже комнатной, то после добавления спирта она может существенно упасть.
Наоборот, если при изначальном равновесии температура смеси была выше комнатной, то энергия выделится из системы при растворении спирта в воде. Это вызывает экзотермическую реакцию, и температура смеси может повыситься.
Таким образом, тепловые эффекты, возникающие при растворении спирта в воде, зависят от соотношения спирта и воды и начальной температуры смеси. Понимание этих эффектов имеет значение для проведения различных химических реакций и процессов, в которых присутствуют спирты и вода.
Свойства растворов спирта в воде
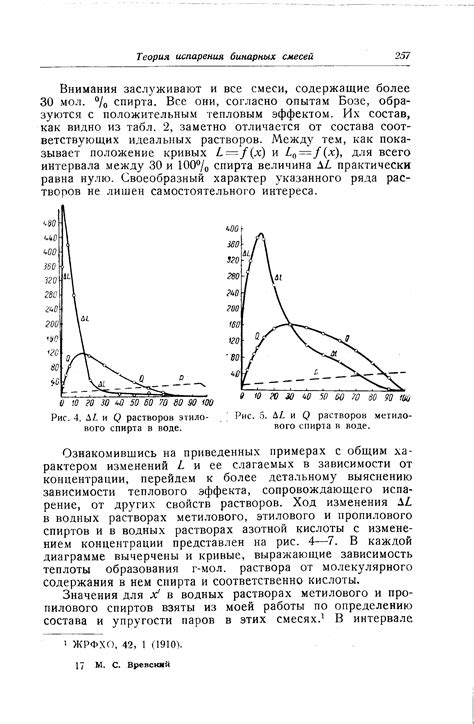
Один из главных характеристик растворов спирта в воде – изменение его физических свойств. Так, точка плавления раствора может быть ниже точки плавления спирта, что говорит о снижении температуры замерзания. Это свойство широко используется при изготовлении антифризов и различных растворов для охлаждения систем.
Кроме того, растворы спирта в воде обладают определенной вязкостью, которая зависит от концентрации спирта. Чем выше концентрация спирта, тем более вязкими становятся растворы.
Важно отметить, что растворы спирта в воде обладают также определенной электропроводностью. Это объясняется тем, что вода является электролитом, а спирт проникает в межмолекулярные пространства воды, создавая проводящие каналы.
Стоит также отметить, что растворы спирта в воде могут образовывать азеотропные смеси, то есть смеси, при которых смесь жидкостей обладает более низким кипящим составом, чем каждая из жидкостей по отдельности.
Применение растворов спирта в воде в различных отраслях

Растворы спирта в воде широко используются в различных отраслях благодаря своим уникальным физическим и химическим свойствам. Вот несколько областей, где применяются такие растворы:
Медицина
В медицине растворы спирта в воде используются для дезинфекции ран и инструментов. Спиртовые растворы также применяются для приготовления различных лекарственных препаратов, так как спирт является отличным растворителем для многих активных составляющих.
Косметическая промышленность
Растворы спирта в воде входят в состав многих косметических продуктов. Они используются в процессе производства шампуней, кондиционеров, растворов для снятия макияжа и других средств для ухода за кожей и волосами.
Пищевая промышленность
Растворы спирта в воде применяются в производстве алкогольных напитков, таких как вино и пиво. Они также используются для экстрагирования ароматических и вкусовых веществ из растительного сырья, таких как травы, специи и фрукты.
Химическая промышленность
В химической промышленности растворы спирта в воде используются в качестве растворителей для различных веществ и реактивов. Также спиртовые растворы используются для проведения реакций и фильтрации в лабораторных условиях.
Важно отметить, что концентрация спирта в растворе имеет большое значение для определенных применений. Различные отрасли могут использовать растворы с разной концентрацией спирта в воде в зависимости от требуемых свойств и эффектов.