В химии существует несколько типов связей между атомами, каждая из которых определяет физические и химические свойства вещества. Одним из самых распространенных типов связей являются металлическая и ковалентная связи. Несмотря на то, что оба типа связей возникают между атомами, у них есть ряд принципиальных различий, определяющих их уникальные характеристики.
Металлическая связь является характерной для металлов, таких как железо, алюминий, медь и многих других. Она основана на свободном движении электронов по всей структуре и образовании положительно заряженных ионов, называемых катионами. Электроны в металлической связи могут свободно переходить от одного атома к другому, создавая электронное облако вокруг катионов.
Ковалентная связь, с другой стороны, возникает между неметаллами, такими как кислород, азот, углерод и др. Она основана на общем использовании электронов для образования пары электронов, называемой электронной парой. Ковалентные связи образуются, когда два атома с неполными внешними электронными оболочками делят свои электроны, чтобы достичь стабильного состояния. В результате образуется молекула, состоящая из атомов, связанных общими электронными парами.
Таким образом, металлическая и ковалентная связь имеют существенные различия в своей структуре и принципах образования. Металлическая связь характеризуется свободным движением электронов и образованием положительно заряженных ионов, в то время как в ковалентной связи атомы делят свои электроны для образования электронных пар. Ознакомление с данными различиями поможет лучше понять особенности и свойства различных веществ и их применение в различных отраслях науки и промышленности.
Металлическая и ковалентная связь: основные принципы и отличия

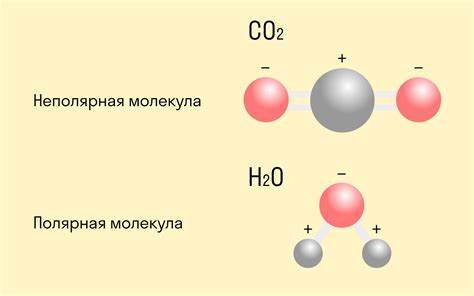
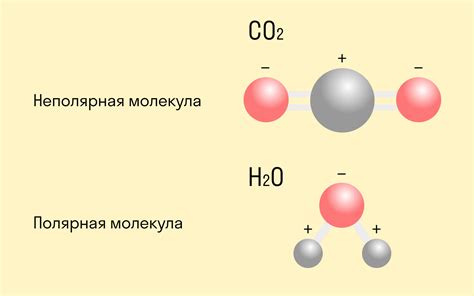
Ковалентная связь - это тип химической связи между атомами неметаллов, характеризующийся общим использованием электронных пар. Ковалентная связь образуется при перекрытии внешних энергетических уровней атомов, при этом образуется общая область электронной плотности - связывающая плоскость. Такая связь позволяет неметаллам образовывать молекулы с устойчивыми энергетическими состояниями и основой для образования химических соединений.
Основное отличие между металлической и ковалентной связью заключается в перемещении электронов. В металлической связи электроны достаточно свободны и могут перемещаться по всей структуре металла. В ковалентной связи электроны образуют общие парные электронные области и участвуют в образовании связей только между двумя атомами.
Другое отличие между металлической и ковалентной связью заключается в структуре и физических свойствах веществ. Металлические соединения обычно обладают высокой плотностью, тугоплавкостью, высокой теплопроводностью и электропроводностью. Ковалентные соединения, напротив, имеют низкую плотность, низкую теплопроводность и электропроводность, но обладают высокой твердостью и точкой плавления.
Таким образом, металлическая и ковалентная связь имеют разные принципы и свойства, что определяет их различное поведение и роль в химических соединениях и материалах.
Металлическая связь: основная характеристика

Металлы обладают низкой электроотрицательностью, что означает, что они имеют большую склонность отдавать электроны. Это приводит к образованию положительно заряженных ионов металла. Одновременно с этим, свободные электроны, находящиеся в металлической сетке, образуют "облако" валентных электронов. Эти электроны практически не привязаны к конкретным атомам и могут свободно двигаться по всей структуре металла.
Движение электронов в металлической связи создает особую структуру, которая обеспечивает основные свойства металлов, такие как тепло- и электропроводность, пластичность и твердость. Электроны с легкостью передают энергию и частицы через структуру металла, что приводит к его высокой электропроводности. Кроме того, свободные электроны также способствуют пластической деформации металла, позволяя ему быть гибким и принимать различные формы.
Металлическая связь также обладает высокой теплопроводностью, поскольку свободные электроны способны эффективно передавать тепловую энергию. Это объясняет, почему металлы быстро нагреваются и охлаждаются.
Важно отметить, что металлическая связь не обязательно означает, что все металлы связаны именно таким образом. Однако основной признак металлов – наличие свободных электронов, обеспечивающих металлическую связь, – является общим для большинства металлических элементов.
Ковалентная связь: принцип образования
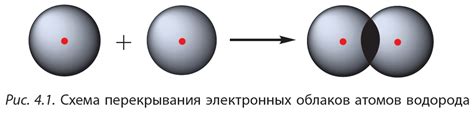
Электроны внешнего энергетического уровня атома, так называемые валентные электроны, играют ключевую роль в образовании ковалентных связей. Когда два атома, имеющих неполный электронный оболочек, подходят близко друг к другу, их валентные электроны начинают перекрываться.
Перекрытие этих электронов образует так называемые молекулярные орбитали, регионы пространства, в которых наиболее вероятно нахождение общих электронов. В результате образуется пара общих электронов, принадлежащих обоим атомам. Пара общих электронов формирует ковалентную связь, обеспечивая стабильность молекулы.
Ковалентная связь характеризуется сильным притяжением электронной пары к ядрам обоих атомов, что обеспечивает их устойчивое положение в молекуле. Силу ковалентной связи можно оценить как сумму энергий, необходимых для отделения электронной пары от атомов.
Принцип образования ковалентной связи объясняет, как атомы обмениваются электронами, чтобы достичь наиболее энергетически выгодного состояния. Ковалентная связь является одним из важнейших механизмов образования химических соединений и определяет их свойства и химическую активность.
Металлическая связь: общие особенности

Главной особенностью металлической связи является наличие деликатного баланса между положительно заряженными металлическими ионами и облаком свободных электронов.
При металлической связи электроны, находящиеся в валентной оболочке металла, образуют общую электронную оболочку. Это позволяет металлу обладать высокой проводимостью электрического тока и тепла.
Кроме того, металлическая связь обеспечивает подвижность и пластичность металлов. Общая электронная оболочка позволяет ионам свободно перемещаться, что делает металлы гибкими и способными выдерживать деформации.
Металлическая связь также отвечает за характерные свойства металлов. Например, благодаря свободным электронам, металлы обладают блеском, высокой плотностью и температурой плавления, а также способностью образовывать сплавы и легкость обработки.
Исторически металлическая связь была первым типом связи, который стал широко применяться человеком в различных отраслях промышленности. Сегодня металлы и их связь являются основой для множества технологий и материалов.
Ковалентная связь: особенности и свойства
Основные особенности ковалентной связи:
| 1. | Связь образуется путем совместного использования электронной оболочки атомами. |
| 2. | Атомы могут образовывать одну или несколько ковалентных связей. |
| 3. | Ковалентная связь может быть полярной или неполярной в зависимости от разности электроотрицательности атомов. |
| 4. | Ковалентная связь может быть одинарной, двойной или тройной в зависимости от количества электронных пар, которые делят атомы. |
| 5. | Ковалентная связь является относительно слабой по сравнению с ионной связью или металлической связью. |
Ковалентная связь обладает такими свойствами, как:
| 1. | Низкая теплопроводность. Это свойство объясняется тем, что ковалентные связи не позволяют свободно перемещаться электронам. |
| 2. | Низкая электропроводность. Аналогично с теплопроводностью, ковалентные связи не позволяют свободному движению зарядов. |
| 3. | Высокая температура плавления и кипения. Поскольку ковалентные связи обладают большой прочностью, требуется большое количество энергии для разрыва связи. |
| 4. | Имеют способность образовывать молекулярные кристаллы, где атомы соединяются через ковалентные связи. |
| 5. | Ковалентные соединения обычно имеют низкую летучесть и плохо растворимы в воде. |
Таким образом, ковалентная связь является важным и распространенным типом связи в химии, обладая своими уникальными свойствами и особенностями.
Металлическая связь: проводимость электричества и тепла
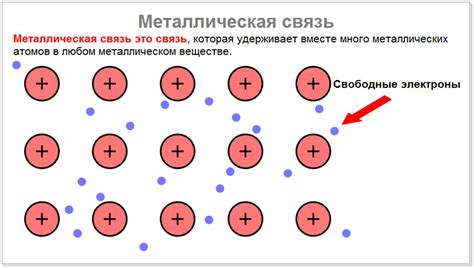
Проводимость электричества в металлах объясняется наличием свободных заряженных частиц - электронов, которые могут свободно перемещаться по кристаллической решетке металла. Это обеспечивает возможность электрического тока, передавая электроны от одной частицы к другой.
В результате этого, металлы обладают высокой электропроводностью и широко применяются в проводниках электрического тока. Свободные электроны также являются причиной специфического блеска металлов и способности их отражать свет.
Кроме того, металлическая связь также обуславливает хорошую проводимость тепла у металлов. Здесь роль играют электроны, которые могут эффективно передавать тепло, обеспечивая быстрое распределение тепловой энергии по всему металлу.
Благодаря проводимости электричества и тепла, металлы нашли применение в жизни человека в различных областях, начиная от электротехники и машиностроения до строительства и химической промышленности. Металлическая связь является одной из основных причин, почему металлические материалы являются неотъемлемой частью современного мира.
Ковалентная связь: атомные и молекулярные соединения
Ковалентная связь может быть образована как между атомами в молекуле, так и между атомами разных молекул. В первом случае говорят об атомных соединениях, а во втором - о молекулярных соединениях.
| Атомные соединения | Молекулярные соединения |
|---|---|
| Образуются при обмене электронами между атомами. | Образуются при обмене электронами между молекулами. |
| Металлические свойства не проявляют. | Могут проявлять металлические свойства. |
| Могут быть ионными. | Обычно не являются ионными. |
| Химически более активны. | Обычно менее активны. |
| Примеры: С2H6, H2O. | Примеры: N2, O2. |
Важно отметить, что многие соединения содержат как ионную, так и ковалентную связи. В этих случаях говорят о полиатомных ионных молекулах. Но в общем случае ковалентная связь характеризуется общими электронными парами между атомами или молекулами.
Изучение ковалентной связи и ее особенностей позволяет понять химические реакции, взаимодействия веществ и свойства соединений, что является важной составляющей химической науки и применяется во многих областях, включая фармацевтическую, материаловедение, нанотехнологии и многие другие.
Металлическая и ковалентная связь: сферы применения

Металлическая связь
- Металлическая связь широко используется в металлургии и производстве металлических материалов. Она позволяет создавать прочные и гибкие металлические конструкции и материалы.
- Металлы с металлической связью находят применение в производстве электроники, электрики и силовой техники, так как они обладают хорошей электропроводностью и теплопроводностью.
- Металлическая связь также играет важную роль в катализе, где металлические катализаторы используются для ускорения химических реакций.
- Металлическая связь используется в приборостроении, в производстве легких и прочных металлических конструкций, авиации и космической промышленности.
Ковалентная связь
- Ковалентная связь широко применяется в органической химии, где она обеспечивает стабильность и формирование органических соединений.
- Ковалентная связь играет важную роль в создании лекарств и фармацевтических препаратов, так как позволяет формировать специфические химические связи и взаимодействия, необходимые для лечения различных заболеваний.
- Ковалентная связь используется в полупроводниковой и микроэлектронной промышленности, чтобы создавать интегральные схемы, транзисторы и другие электронные компоненты.
- Ковалентная связь применяется в производстве полимеров и пластиков, где она обеспечивает прочность и стабильность материала.
Таким образом, металлическая и ковалентная связь имеют широкие области применения и играют важную роль в различных научных и технических отраслях, способствуя развитию новых материалов и технологий.