Химия – прекрасная наука, изучающая строение веществ и их свойства. Знания в этой области помогают нам понять, как происходят химические реакции и использовать их в нашей повседневной жизни. Предмет «Химия» в 8 классе становится более углубленным, поэтому стоит обратить особое внимание на практическую сторону этого предмета. В данной статье мы рассмотрим несколько эффективных примеров, которые помогут вам лучше разобраться в химии и применить эту науку на практике.
Один из примеров, который можно встретить в учебнике по химии, – определение неполярности и полярности молекул. Для этого можно использовать знания о электроотрицательности элементов. Если разность электроотрицательностей двух элементов в молекуле равна нулю или очень близка к нулю, то молекула считается неполярной. В противном случае, если разность электроотрицательностей достаточно велика, молекула считается полярной. В этом примере можно воспользоваться моделями молекул, чтобы проиллюстрировать различие между неполярными и полярными молекулами.
Другой практический пример, который может помочь в понимании химических принципов, – эксперименты с различными видами реакций. В 8 классе обычно проводятся эксперименты по получению газов, окислительно-восстановительным реакциям, реакциям сильных кислот и щелочей, а также некоторым другим видам реакций. Эти эксперименты позволяют ученикам увидеть химические превращения в реальном времени, что помогает им лучше запомнить и понять материал.
Важно помнить, что во время проведения экспериментов необходимо соблюдать все меры безопасности. Использование средств индивидуальной защиты, правильное использование химических веществ и следование инструкциям – это очень важные аспекты, которые нельзя игнорировать. Поэтому перед проведением любого эксперимента, убедитесь, что имеете все необходимые средства и знания для безопасной работы.
Практические примеры химии 8 класс

Вот несколько практических примеров, которые помогут ученикам углубить свои знания и улучшить понимание химических процессов:
- Исследование свойств воды: проведите эксперимент, чтобы проверить, как вода изменяет свои физические свойства при различных температурах. Для этого можно взять несколько стаканов с водой и нагреть один стакан, охладить другой, а третий оставить комнатной температуры. Затем можно наблюдать, как вода меняется.
- Определение pH-значения различных веществ: используйте индикаторные бумажки, чтобы измерить pH-значение различных веществ, таких как лимонный сок, молоко, сок томата и т. д. Этот эксперимент поможет ученикам понять, что pH-значение может указывать на кислотность или щелочность вещества.
- Разложение пищевой соды: сделайте эксперимент с разложением пищевой соды с помощью уксуса. Положите немного пищевой соды на дно стакана, затем добавьте немного уксуса. Наблюдайте, как смесь начинает пениться и выделять газ.
- Исследование сольных растворов: приготовьте растворы соли разной концентрации, используя стаканы с водой и солью. Затем определите, как изменяется вкус и прозрачность растворов в зависимости от концентрации соли.
Эти практические примеры помогут ученикам не только применить свои знания изученной теории, но и развить навыки наблюдения, анализа и экспериментирования в химических процессах. Ученики также смогут лучше понять взаимосвязь между теорией и практикой в химии.
Как провести опыт с газами в домашних условиях

Эксперименты с газами в домашних условиях могут быть не только интересными, но и полезными для изучения свойств и особенностей различных газов, а также их взаимодействия с другими веществами. В этом разделе представлены несколько простых и безопасных опытов, которые можно провести самостоятельно.
1. Опыт с дымящими свечами:
Для проведения этого опыта потребуются две свечи одинаковой высоты и цвета. Зажгите одну свечу и поставьте ее на стол. Расположите вторую свечу на расстоянии около 10 см от первой свечи. Затем, аккуратно покройте вторую свечу стаканом или колпаком из фольги. Через некоторое время вы заметите, что покрытая свеча начнет тушиться из-за недостатка кислорода внутри стакана.
2. Опыт с искривленным струйкой воды:
Для проведения этого опыта потребуется пластиковая пустая бутылка с широким горлышком, вода, керосин или другая легковоспламеняющаяся жидкость и зажигалка. Наполните бутылку до половины водой и добавьте небольшое количество жидкости, которая может гореть (керосин). Плотно закройте горлышко бутылки ладонью и переверните ее, так чтобы огонь подействовал на самое горлышко. Через некоторое время вы заметите, что струйка воды искривится под действием горящего керосина.
3. Опыт с мыльными пузырями:
Для проведения этого опыта потребуется мыльный раствор и судно с водой. Наверните крышку совсем на небольшую трубку, чтобы получить пузырек. Поставьте судно с водой так, чтобы сам пузырек висел в воде. Внимательно посмотрите на расположившийся внутри воды пузырек - волнение не замечайте вы, а то попытайтесь снова.
Помните, что проведение опытов с газами требует осторожности и соблюдения безопасность. Для более сложных опытов лучше обратиться за помощью к опытному химику или преподавателю.
Эксперименты с растворами на уроках химии

Растворы играют важную роль в изучении химии на уроках. Использование экспериментов с растворами позволяет учащимся увидеть, как субстанции взаимодействуют друг с другом и какие изменения происходят при смешивании веществ.
Эксперименты с растворами предоставляют учащимся возможность:
- На практике проверять различные химические реакции и законы;
- Наблюдать изменения состояния веществ и цвета растворов;
- Получать новые знания, опираясь на собственный опыт;
- Разрабатывать и проверять гипотезы;
- Развивать навыки наблюдения, экспериментального и логического мышления.
Приведенные ниже примеры экспериментов с растворами могут служить прекрасным инструментом для обучения и развития учащихся:
1. Эксперимент с растворимостью: Возьмите несколько палочек или кристаллов различных веществ и попробуйте растворить их в разных растворах (вода, спирт, уксус). Наблюдайте, какие вещества растворяются, а какие нет. Объясните полученные результаты на основе взаимодействия между молекулами.
2. Эксперимент с изменением pH: Подготовьте три стакана с водой и добавьте в них кислоту, щелочь и нейтральное вещество (например, лимонный сок, натрия гидроксид и сахар respectively). Используя индикаторы pH, определите кислотность или щелочность каждого раствора. Объясните полученные результаты на основе концентрации ионов водорода и гидроксида.
3. Эксперимент с реакцией замещения: Погрузите полоску меди в раствор серной кислоты и наблюдайте, как меняется цвет раствора и поверхности полоски. Объясните полученные результаты на основе реакции замещения меди на водород в серной кислоте.
Эти эксперименты позволяют учащимся активно взаимодействовать с химическими веществами и лучше понять их свойства. Учащиеся не только получают новые знания, но и развивают навыки наблюдения, анализа и логического мышления. Результаты экспериментов помогают им лучше запомнить химические процессы и закрепить изученный материал.
Примеры химических реакций на кухне

1. Реакция при приготовлении пирога. Когда смешиваются различные ингредиенты, такие как мука, яйца, сахар и разрыхлитель, происходит химическая реакция. При нагревании в духовке газовые пузырьки, образовавшиеся в результате реакции, расширяются, что делает пирог пышным и воздушным.
2. Окисление яблок. Когда нарезанные яблоки контактируют с воздухом, происходит окисление. В результате окисления, белое мякоть яблока становится коричневой. Чтобы предотвратить окисление, можно покрыть нарезанные яблоки лимонным соком, который содержит антиоксиданты и замедляет процесс окисления.
3. Приготовление мороженого. Для приготовления мороженого используется реакция замораживания. Смесь молока, сахара и других ингредиентов закладывается в мороженицу или помещается в морозильник. При низкой температуре происходит замерзание воды в смеси, что позволяет получить мороженое.
4. Замешивание теста. При замешивании теста для выпечки хлеба или печенья, глютен, содержащийся в муке, образует эластичные нити. Эти нити дают тесту упругость и эластичность, что позволяет выпечке сохранять форму во время приготовления.
5. Поджаривание мяса. При поджаривании мяса на сковороде происходит много химических реакций, которые придают мясу особый вкус и аромат. Например, в результате реакции маилларда, сахар и аминокислоты в мясе дают корочку с приятной хрустящей текстурой.
Эти примеры показывают, что химия имеет большое значение в нашей кухне. Разумное использование и понимание этих химических реакций может помочь нам стать более эффективными и творческими поварами.
Как измерить рН-уровень с помощью индикаторов

Индикаторы - это вещества, которые изменяют свой цвет в зависимости от рН-уровня раствора. Существует множество различных индикаторов, каждый из которых реагирует на определенный диапазон рН. Некоторые индикаторы меняют свой цвет в кислой среде, другие - в щелочной, а некоторые - в нейтральной.
Для измерения рН-уровня с помощью индикаторов необходимо провести следующие шаги:
- Выберите подходящий индикатор в зависимости от ожидаемого диапазона рН.
- Подготовьте небольшое количество раствора, в котором необходимо измерить рН-уровень.
- Добавьте небольшое количество индикатора в раствор.
- Наблюдайте за изменением цвета раствора. В зависимости от рН-уровня, цвет может измениться в кислую, щелочную или нейтральную сторону спектра.
- Сравните полученный цвет со шкалой цветов, чтобы определить рН-уровень раствора.
Важно помнить, что точность измерения рН-уровня с помощью индикаторов может быть ограничена, поэтому для более точных результатов рекомендуется использовать более точные методы измерения, такие как pH-метр. Однако использование индикаторов является простым и доступным способом для оценки рН-уровня на домашней лабораторной практике или в учебных целях.
Методы определения оксидационно-восстановительного потенциала

Существует несколько методов определения оксидационно-восстановительного потенциала. Они основаны на измерении различных параметров, связанных с процессами окисления и восстановления.
| Метод | Описание |
|---|---|
| Потенциометрический метод | Измерение электродного потенциала системы на равновесии. Этот метод позволяет определить ОВП, основываясь на изменении потенциала электрода при изменении оксидационного состояния вещества. |
| Амперометрический метод | Измерение тока прохождения электрического тока через систему в условиях изменения окислительно-восстановительных свойств. Этот метод используется для определения окислительных и восстановительных свойств веществ. |
| Потенциокинетический метод | Измерение изменения тока при изменении потенциала системы в процессе окислительно-восстановительных реакций. Точные значения ОВП могут быть получены путем исследования кинетики этих изменений. |
Методы определения оксидационно-восстановительного потенциала широко применяются в аналитической химии для изучения свойств веществ и составления реакционных механизмов. Они играют важную роль в понимании процессов окисления и восстановления, а также в разработке новых технологий и материалов.
Практическое применение экзотермических реакций

| Область применения | Пример |
|---|---|
| Теплоснабжение | Использование теплоэлектростанций для получения тепла и электроэнергии в жилых домах и промышленных объектах. |
| Химическая промышленность | Производство энергоемких продуктов, таких как алюминий, с помощью реакций окисления. |
| Пиротехника | Использование экзотермических реакций для создания эффектов в фейерверках и пиротехнических изделиях. |
| Взрывчатые вещества | Производство взрывчатых веществ и пиротехнических смесей, которые могут выделять большое количество тепла и газов при детонации. |
| Энергетическая отрасль | Использование ядерных реакций для производства электроэнергии с использованием заряженных частиц. |
Эти примеры демонстрируют, что экзотермические реакции играют важную роль в нашей жизни и имеют множество практических применений. Изучение этих реакций помогает нам понять, как можно оптимизировать процессы и сделать их более эффективными.
Методы выделения и идентификации газов

1. Метод газовых сборов: Этот метод основан на сборе газа, выделяемого из реагирующих веществ. Газ собирается в специальном контейнере, таком как колба с пипеткой или герметичный шар. Затем газ анализируется с помощью различных методов, таких как спектроскопия или хроматография.
2. Метод потоков газа: Этот метод используется для идентификации газов путем прохождения их через реагенты или химические растворы. При прохождении газа через реагенты, может происходить образование новых веществ или изменение цвета раствора, что помогает определить состав газовой смеси.
3. Метод газовой анализации: Этот метод заключается в применении различных аналитических методов для идентификации газов, таких как газовая хроматография, масс-спектрометрия или спектроскопия. Эти методы позволяют определить состав газовой смеси, а также концентрацию и структуру отдельных газов в смеси.
4. Метод диффузии газов: Этот метод основан на различной скорости диффузии газов внутри закрытого сосуда. Путем измерения скорости диффузии различных газов можно идентифицировать их. Например, газ с более высокой скоростью диффузии будет диффундировать через некоторое расстояние быстрее, чем газ с меньшей скоростью диффузии.
Идентификация газов является важной задачей для химиков и помогает в дальнейшем изучении и использовании этих веществ в различных областях науки и промышленности.
Примеры использования реакций соляной кислоты

Соляная кислота, также известная как хлороводородная кислота, широко используется в химической промышленности и научных исследованиях благодаря своей активности и универсальности.
Вот несколько примеров использования реакций соляной кислоты:
- Очистка металлов: Соляная кислота используется для удаления окислов и других загрязнений с поверхности металлов. Реакция между соляной кислотой и металлом происходит с выделением водорода и образованием соответствующего солевого соединения.
- Производство хлорида натрия: Соляная кислота реагирует с гидроксидом натрия, образуя хлорид натрия и воду. Это реакция нейтрализации, при которой образуется соль и вода.
- Получение газа хлора: Реакция между соляной кислотой и марганцем(IV) оксидом приводит к выделению газа хлора. Этот газ может быть использован в различных процессах, включая производство пластиков и дезинфекцию воды.
- Производство гидроксида алюминия: Реакция соляной кислоты с гидроксидом алюминия приводит к образованию алюминия солянокислого.
- Получение хлорида железа(III): Соляная кислота реагирует с сульфатом железа(III), образуя хлорид железа(III) и серную кислоту.
Это лишь некоторые примеры использования реакций соляной кислоты. Она играет важную роль во многих отраслях и областях, например, в производстве химических веществ, пищевой промышленности и медицине.
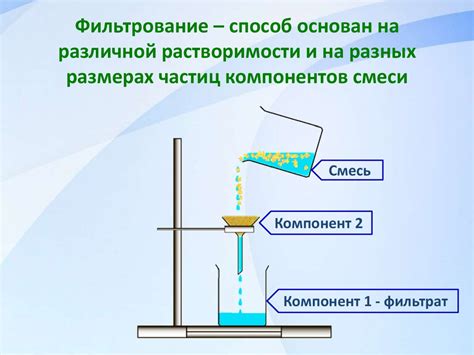
Эффективные методы разделения смесей в химии
- Дистилляция. Данный метод основан на различии температур кипения компонентов смеси. С помощью специального аппарата, называемого дистилляционной колонной, можно получить пары отдельных компонентов смеси, затем они конденсируются и собираются в отдельные сосуды.
- Экстракция. Для разделения смеси используют различия в растворимости компонентов в различных растворителях. Смесь перемешивается с растворителем, в результате чего один из компонентов растворяется, а другой остается в оседле. Затем раствор собирается и выпаривается, чтобы получить исходное вещество.
- Хроматография. Этот метод основан на разделении компонентов смеси при прохождении через специальное пористое вещество. Каждый компонент имеет различную скорость движения через вещество, что позволяет разделить их на отдельные фракции.
- Ионно-обменная хроматография. Данный метод используется для разделения и очистки ионных растворов и включает в себя использование специальных смол, способных сохранять ионы компонентов.
- Фильтрация. Для разделения твердых частиц от жидкости или газа используется фильтр, который позволяет пропускать только определенные частицы. Таким образом, оставшиеся компоненты смеси остаются на фильтре, а чистое вещество проходит через него.
Это лишь некоторые из эффективных методов разделения смесей в химии. Конкретный выбор метода зависит от свойств и состава смеси, а также от целей исследования или производства.