Ионное уравнение - это уравнение, которое описывает химическую реакцию, в которой участвуют ионы. Оно отображает взаимодействие ионов веществ, а также показывает изменения заряда и числа ионов на каждом этапе реакции.
Чтобы построить ионное уравнение, необходимо следовать нескольким правилам и выполнять определенные шаги. Во-первых, нужно анализировать реакцию и определить, какие ионы участвуют в ней. Затем следует записать эти ионы в реакцию и указать их заряды.
Во-вторых, для каждого иона необходимо учесть сохранение заряда. Общая сумма зарядов на одной стороне уравнения должна быть равна сумме зарядов на другой стороне.
Наконец, следует проверить сбалансированность уравнения по числу ионов. Если на одной стороне реакции находится больше ионов, чем на другой, необходимо добавить коэффициенты перед ионами, чтобы уравнять число ионов на обеих сторонах.
Построение ионного уравнения требует понимания основ химии и знания химических свойств веществ. Приведенные выше правила и шаги помогут вам эффективно и правильно построить ионное уравнение, а также лучше понять химические реакции и их механизмы.
Что такое ионное уравнение и зачем оно нужно?

Ионное уравнение имеет важное значение для понимания и изучения различных химических процессов. Оно позволяет легче определить, какие реакции протекают между различными веществами, включая реакции в растворах и реакции в твердом состоянии.
Благодаря ионному уравнению можно понять, какие ионы взаимодействуют в процессе и какие ионы остаются непроизведенными после завершения реакции. Это особенно полезно при изучении реакций в растворах, где происходит образование новых соединений и образование осадка.
Основными целями ионного уравнения являются:
- Учет ионных формул и зарядов ионов в реакции.
- Определение типа реакции (например, двойная замена, окислительно-восстановительная реакция и т. д.).
- Определение продуктов реакции и бесплатных ионов.
Таким образом, ионное уравнение помогает наглядно представить происходящие в химической реакции изменения и состав веществ до и после реакции. Оно является неотъемлемой частью химического анализа и химических расчетов, а также находит широкое применение в образовании и многих других областях науки и техники.
Определение и цель
Цель построения ионного уравнения состоит в том, чтобы представить реакцию в виде передвижения ионов, а не молекул. Ионное уравнение позволяет лучше понять, какие вещества реально участвуют в реакции и как меняются их состояния.
Построение ионного уравнения может быть полезным во многих случаях, например:
- При изучении реакций, связанных с образованием ионов в растворах
- При анализе реакций, происходящих в электрохимических системах
- При изучении строения ионных реакций и свойств ионов
- При проведении химических экспериментов и вычислении количества вещества
Ионное уравнение является важным инструментом в химических расчетах и позволяет получать более точные результаты, учитывая ионные взаимодействия и переходы.
Шаги выполнения ионного уравнения
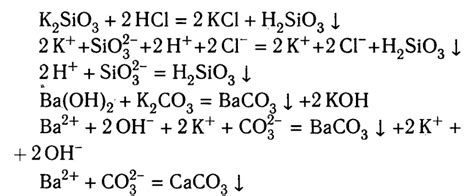
1. Изучите реакцию и точно определите исходные вещества и продукты. Например, если дана реакция между натрием (Na) и хлором (Cl), определите, что Na является ионом Na+ , а Cl является ионом Cl-.
2. Напишите уравнение с учетом ионов. Используя информацию о зарядах ионов, напишите уравнение, раскрывая ионные формулы. В случае с Na и Cl, уравнение будет выглядеть как Na+ + Cl- → NaCl.
3. Проверьте сбалансированность уравнения. Удостоверьтесь, что в уравнении число зарядов на левой и правой стороне совпадает. Если уравнение несбалансированное, добавьте коэффициенты перед ионами или молекулами так, чтобы количество положительных и отрицательных зарядов было равным.
4. Проверьте правильность записи ионов. Убедитесь, что запись ионов верна и отражает их заряд. В случае соединения Na и Cl, Na+ означает, что натрий потерял один электрон, а Cl- означает, что хлор получил один электрон.
Правильное выполнение этих шагов позволит вам составить корректное ионное уравнение.
Выбор соединений для составления ионного уравнения

При составлении ионного уравнения необходимо выбрать правильные соединения, которые будут участвовать в реакции. Здесь мы рассмотрим несколько основных правил для выбора соединений.
- Ионные соединения: предпочтение отдаётся веществам, которые образуют ионы. Например, все соли, металлы, кислоты и щелочи. Они обычно являются электролитами и разлагаются на положительные и отрицательные ионы при растворении или плавлении.
- Растворимость вещества: выбираются только те соединения, которые растворимы в данной среде. Некоторые вещества могут быть нерастворимыми и не будут участвовать в реакции. Знание правил растворимости поможет определить, какие ионы образуются при растворении вещества.
- Соединения в составе реагентов: анализируются начальные соединения, которые заданы как реагенты в химической реакции. Они могут указывать, какие продукты будут образовываться.
- Закон сохранения заряда: обратите внимание на валентность ионы, чтобы учесть закон сохранения заряда. Заряды положительных и отрицательных ионов в реагентах и продуктах должны быть сбалансированы.
- Учет физического состояния: иногда для составления ионного уравнения может потребоваться учет физического состояния веществ. Например, газы, жидкости или твердые вещества.
Правильный выбор соединений для составления ионного уравнения является важным шагом в процессе химического анализа и может обеспечить правильное понимание химической реакции.
Расчет заряда ионов и степени окисления

При построении ионного уравнения важно определить заряд ионов и их степень окисления. Заряд иона определяется числом электронов, которые он принял или отдал.
Для расчета заряда иона нужно знать его химическую формулу и его структуру. Заряд металлических ионов соответствует их валентности, то есть количеству электронов, которые металл отдал или принял.
Для неметаллических ионов заряд можно определить по основным правилам:
- Группа VII отдает 1 электрон и образует отрицательный ион с зарядом -1.
- Группа VI отдает 2 электрона и образует отрицательный ион с зарядом -2.
- Группа V отдает 3 электрона и образует отрицательный ион с зарядом -3.
В случае, если неметалл образует положительный ион, его заряд можно определить как противоположность абсолютной величины отрицательного заряда.
Степень окисления иона определяется отношением числа электронов, которые он принял или отдал, к числу электронов в его нейтральном состоянии.
Определение заряда и степени окисления ионов важно для построения ионного уравнения и понимания химической реакции.
Правила балансирования ионного уравнения

Основные правила балансировки ионного уравнения:
| Правило | Описание |
|---|---|
| 1. Количество атомов каждого элемента должно быть одинаковым с обеих сторон уравнения. | Для этого необходимо использовать коэффициенты перед формулами веществ. |
| 2. Сумма зарядов ионов должна быть одинаковой с обеих сторон уравнения. | Для ионов с положительным зарядом (катионов) используется знак "+" перед коэффициентом, а для ионов с отрицательным зарядом (анионов) - знак "-". |
| 3. Если вещество содержит один и тот же ион с разным зарядом, то его количество и заряды должны быть сбалансированы. | Для этого можно использовать квадратные скобки и заряд иона внутри них перед формулой вещества. |
| 4. Водород и кислород могут быть добавлены в виде молекул воды для балансировки кислородных и водородных атомов. | Обычно вода указывается как H2O. |
При балансировке ионного уравнения необходимо следовать этим правилам, чтобы получить правильный ответ и установить соотношение между веществами в реакции.
Работа с многозначными элементами

При построении ионного уравнения часто встречаются многозначные элементы, которые могут образовывать ионы разного заряда. Некоторые из них могут иметь только положительные или только отрицательные ионы, но есть и такие, которые образуются сразу несколькими ионами разного заряда.
Для работы с многозначными элементами нужно учесть следующие правила:
- Внимательно изучите формулу многозначного элемента и определите его заряд. Заряд элемента можно найти в периодической системе элементов или с помощью других источников. Например, для определения заряда железа (Fe), можно воспользоваться таблицей "Заряды основных химических элементов".
- Если многозначный элемент образует положительные ионы, его заряд обозначается римскими цифрами в названии соответствующего иона. Например, Fe2+ - ион железа (II).
- Если многозначный элемент образует отрицательные ионы, к его названию добавляется слово "ида" и уменьшается на единицу заряд элемента. Например, хлор - Cl, а хлорид - Cl-.
- В ионном уравнении многозначные элементы отображаются в виде ионов с указанием их зарядов. Например, в ионном уравнении для образования железа (II) и сероводорода (H2S) можно записать Fe2+ + H2S -> FeS + H2.
Необходимо помнить о заряде многозначных элементов при составлении ионного уравнения, чтобы правильно определить соотношение между ионами в реакции. Это поможет избежать ошибок и упростит работу с многозначными элементами.
Примеры и практическое применение ионных уравнений
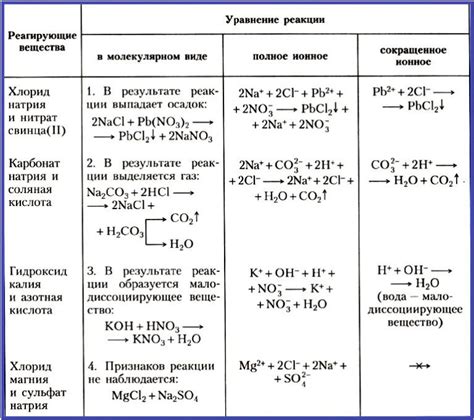
Ионные уравнения используются для описания реакций, происходящих в растворах. Они позволяют определить, какие ионы участвуют в реакции и какие формируются в результате.
Применение ионных уравнений в практике имеет широкий спектр. Например, в химии они позволяют предсказать и объяснить образование осадков, обмен ионами в растворах, реакции окисления-восстановления и многие другие процессы.
Ниже приведены примеры практического применения ионных уравнений:
- Осадки: ионные уравнения позволяют предсказать образование осадка в растворе при реакции двух растворов с растворяющими свойствами. Например:
- CaCl2 + Na2CO3 → CaCO3 + 2NaCl
- Растворимость солей: проведение ионного уравнения позволяет определить растворимость соли в воде. Например:
- Pb(NO3)2 + 2NaCl → PbCl2 + 2NaNO3
- Реакции окисления-восстановления: ионные уравнения помогают описать реакции, в которых происходят окисление или восстановление одного или нескольких веществ. Например:
- 2FeCl2 + Cl2 → 2FeCl3
- Кислотно-основные реакции: ионные уравнения используются для описания реакций, в которых образуются соли при взаимодействии кислоты и основания. Например:
- HCl + NaOH → NaCl + H2O
- Процессы обмена ионами: ионные уравнения применяются для описания реакций обмена ионами между различными соединениями. Например:
- 2NaCl + Pb(NO3)2 → 2NaNO3 + PbCl2
Изучение и применение ионных уравнений позволяют более полно разобраться в химических реакциях, происходящих в растворах, и предсказывать их результаты на основе знания свойств ионов и солей.