Цитомегаловирусная инфекция (ЦМВ) является одним из наиболее распространенных вирусных заболеваний у людей. Она вызывается цитомегаловирусом (ЦМВ), который принадлежит к семейству герпесвирусов.
Полимеразная цепная реакция (ПЦР) является самым распространенным методом диагностики ЦМВ. Она позволяет обнаружить наличие вируса в организме пациента с высокой точностью и чувствительностью.
Существует несколько методов ПЦР для определения наличия ЦМВ в организме. Один из них - квалифицированная ПЦР, который позволяет определить количество вируса в образце. Другой метод, известный как два стадии ПЦР, осуществляется в два этапа - первый этап позволяет определить наличие вируса, а второй этап дает возможность уточнить количество вирусных частиц. Еще один метод - реал -тайм ПЦР, который позволяет определить количество вируса в реальном времени.
Обнаружение ЦМВ-ПЦР является определенной и точной процедурой. Она играет важную роль в диагностике и мониторинге эффективности лечения ЦМВ-инфекции. Данные методы имеют большое значение для пациентов с иммунодепрессивными состояниями, новорожденных, а также для пациентов с высоким риском развития осложнений от ЦМВ-инфекции.
Что такое ЦМВ-ПЦР?

Метод ЦМВ-ПЦР основан на амплификации (увеличении количества) специфической области ДНК вируса, используя специальные праймеры, комплементарные к этой области. После амплификации образцы обрабатываются с помощью гелевой электрофореза и обнаруживаются с помощью специальных флуоресцентных маркеров или гибридизации.
ЦМВ-ПЦР является очень чувствительным и специфичным методом для выявления наличия ЦМВ в организме пациента. Он может использоваться для диагностики инфекции ЦМВ, определения степени прогрессирования болезни, оценки эффективности лечения и мониторинга рецидивов. Благодаря своей высокой чувствительности, ЦМВ-ПЦР позволяет обнаружить вирус уже на ранних стадиях инфекции, когда другие методы могут оказаться недостаточно эффективными.
| Преимущества ЦМВ-ПЦР: | Недостатки ЦМВ-ПЦР: |
| Высокая чувствительность | Высокая стоимость |
| Высокая специфичность | Необходимость специального оборудования и опыта для проведения |
| Может использоваться для диагностики и мониторинга | Возможность ложноположительных и ложноотрицательных результатов |
В целом, ЦМВ-ПЦР является надежным и эффективным методом для обнаружения и мониторинга инфекции цитомегаловирусом. Он позволяет проводить раннюю диагностику, оценивать эффективность лечения и предупреждать развитие осложнений у пациентов с ослабленной иммунной системой.
Цели и применение ЦМВ-ПЦР
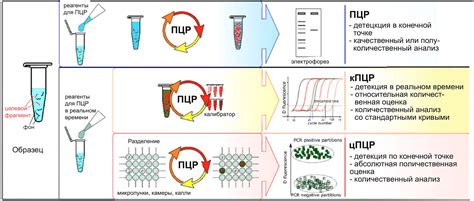
ЦМВ-ПЦР позволяет выявить наличие вируса в организме, определить его концентрацию и определить степень активности инфекции. Метод основан на возможности определить наличие цитомегаловирусной ДНК в биологическом образце пациента. ДНК вируса специфически обнаруживается с использованием праймеров, которые затем амплифицируются с помощью ферментов, таких как термостабильная ДНК-полимераза.
ЦМВ-ПЦР имеет широкий спектр применений. В клинической практике он используется для диагностики и мониторинга уровня ЦМВ-инфекции у пациентов с ослабленной иммунной системой, а также для выявления реактивации вируса после пересадки органов или костного мозга. Метод также может быть применен для оценки эффективности лечения противовирусными препаратами, контроля за безопасностью переливания крови и тканевых препаратов, и определения перинатальной передачи ЦМВ от матери к плоду.
Обнаружение и мониторинг ЦМВ-инфекции с помощью ЦМВ-ПЦР является важным инструментом в клинической практике, позволяющим своевременно выявлять и контролировать инфекцию, что может повысить эффективность лечения и улучшить прогноз заболевания для пациента.
Методы проверки наличия ЦМВ-ПЦР

Существует несколько различных методов ПЦР, которые могут быть использованы для обнаружения ЦМВ. Одним из них является квалификационная ПЦР, которая позволяет определить наличие и количество вирусной ДНК или РНК в образце. Этот метод основан на усилении изначального вирусного материала с использованием специфических праймеров и ДНК- или РНК-зависимой ДНК-полимеразы.
Кроме того, существует качественный метод ПЦР, который позволяет только определить наличие вирусной ДНК или РНК в образце, но не дает информации о количестве вируса. Этот метод основан на обнаружении специфического фрагмента ДНК или РНК с использованием праймеров и ДНК- или РНК-зависимой ДНК-полимеразы.
Методы ПЦР обладают высокой чувствительностью и специфичностью, что делает их идеальными инструментами для обнаружения ЦМВ. Однако, перед использованием этих методов необходимо правильно собрать и обработать образцы, а также соблюдать все необходимые протоколы и стандарты качества. Правильная интерпретация результатов также требует определенных навыков и знаний.
В целом, методы ПЦР представляют собой эффективный инструмент для диагностики ЦМВ-инфекции и позволяют контролировать ее прогресс, оценивать эффективность лечения и принимать необходимые меры по предупреждению распространения инфекции.
Метод полимеразной цепной реакции (ПЦР)
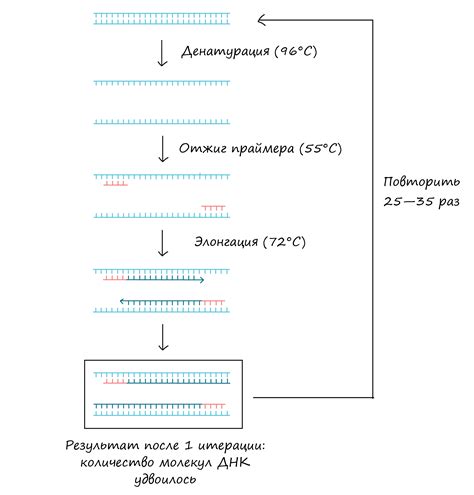
ПЦР основана на способности фермента ДНК-полимеразы к амплификации очень малых количеств ДНК. В процессе реакции проводится несколько циклов нагревания и охлаждения, что приводит к удвоению количества ДНК каждый цикл. Таким образом, исходное количество ЦМВ-DNA может быть увеличено в тысячи раз.
Для проведения ПЦР-анализа требуется небольшое количество образца ткани, крови или другого поврежденного ДНК материала. ПЦР-амплификация ЦМВ-DNA может быть использована для обнаружения и изоляции вируса, а также для определения его генетического состава и вирусных нагрузок.
Основным преимуществом метода ПЦР является его высокая чувствительность и специфичность, что позволяет детектировать наличие ЦМВ-ДНК даже в самых малых количествах. Это делает ПЦР основным методом проверки наличия ЦМВ и альтернативой для других методов, таких как иммунофлуоресцентное окрашивание или серологические тесты.
Иммуноферментный анализ (ИФА)

В процессе ИФА изолируются и очищаются антитела, способные связываться с антигенами ЦМВ. Затем, образец крови пациента наносится на особое стекло или полимерное покрытие, на котором ранее были нанесены антигены ЦМВ. Если в образце есть антитела к ЦМВ, они свяжутся с соответствующими антигенами, а затем будут обнаружены с помощью специальных ферментов, которые добавляются в пробу после первичной реакции.
Результаты ИФА могут быть квалифицированы как положительные (наличие антител к ЦМВ), отрицательные (отсутствие антител) или сомнительные (недостаточно высокая концентрация антител). Количественные результаты могут также быть получены, чтобы определить степень инфекции или иммунного ответа на ЦМВ.
ИФА является высокочувствительным и специфичным методом, который позволяет обнаружить наличие антител к ЦМВ уже через несколько дней после начала инфекции. Он широко используется в клинической практике для диагностики ЦМВ-инфекции и контроля эффективности лечения.
Анализ крови и тканей

Методы проверки наличия ЦМВ-ПЦР позволяют выявить наличие вируса цитомегаловируса (ЦМВ) в крови и тканях пациента. ЦМВ-инфекция может протекать бессимптомно и не вызывать никаких проблем, однако у людей с ослабленной иммунной системой, таких как пациенты с ВИЧ-инфекцией или органы трансплантации, ЦМВ может стать серьезной угрозой.
Для анализа крови и тканей на наличие ЦМВ используется метод полимеразной цепной реакции (ПЦР). Этот метод позволяет обнаружить и идентифицировать ДНК вируса ЦМВ. ПЦР является наиболее чувствительным методом диагностики ЦМВ и может определить наличие вируса даже при низкой концентрации.
Для проведения анализа наличия ЦМВ-ПЦР необходимо собрать образцы крови, слюны, мочи или тканей пациента. После сбора образцов они отправляются в лабораторию для дальнейшего анализа. В лаборатории проводят ПЦР с использованием специальных пробирок и реагентов, которые определяют наличие вирусной ДНК.
Обнаружение ЦМВ методом ПЦР может быть полезным при диагностике и лечении пациентов с ослабленной иммунной системой. Также этот метод может использоваться для мониторинга эффективности лечения и контроля за прогнозом заболевания.
Важно отметить, что для проведения анализа наличия ЦМВ-ПЦР необходимо обратиться к специалисту и получить соответствующее направление. Только врач может правильно интерпретировать результаты анализа и назначить дальнейшее лечение при необходимости.
Подробное руководство по выполнению ЦМВ-ПЦР

Материалы и оборудование:
- Пробирки для реакции ПЦР
- Термоциклер
- Прибор для экстракции ДНК
- PCR-примеси для специфического распознавания ЦМВ
- Негативный контроль (Образец ДНК без ЦМВ)
- Позитивный контроль (Образец ДНК с ЦМВ)
Процедура:
- Подготовьте пробирки для реакции ПЦР. Обозначьте их правильными метками, чтобы избежать ошибок.
- Выполните экстракцию ДНК из образцов, которые требуется проверить на наличие ЦМВ. Следуйте инструкциям, прилагающимся к прибору для экстракции ДНК.
- Разморозьте и перемешайте PCR-примеси для специфического распознавания ЦМВ перед использованием.
- Подготовьте реакционную смесь в каждой пробирке для ПЦР следующим образом:
- Добавьте в каждую пробирку следующие компоненты:
- Образец ДНК (5-10 мкл)
- PCR-примеси для специфического распознавания ЦМВ (1 мкл)
- ДНК-полимеразу (0,5 мкл)
- Смесь дезоксирибонуклеотид-трифосфатов (dNTP) (1 мкл)
- Буфер реакции (10 мкл)
- Милли-Q вода (до 50 мкл)
- Тщательно перемешайте содержимое каждой пробирки и закройте их крышками.
- Поместите пробирки в термоциклер и выполните следующие циклы амплификации:
- Денатурация (95°C, 3 мин)
- 30 циклов следующих шагов:
- Денатурация (95°C, 30 сек)
- Отжиг (55°C, 30 сек)
- Экстенсия (72°C, 30 сек)
- Окончательная экстенсия (72°C, 10 мин)
- Проверьте полученные результаты ЦМВ-ПЦР при помощи электрофореза на агарозном геле и визуализируйте полосы амплифицированной ДНК с помощью ультрафиолетового света.
- Сравните полученные результаты с негативным и позитивным контролем, чтобы определить наличие или отсутствие ЦМВ в образцах.
Следуя этому подробному руководству, вы сможете эффективно выполнить ЦМВ-ПЦР и получить результаты, необходимые для диагностики ЦМВ-инфекции. Не забывайте принимать все необходимые меры предосторожности и утилизировать отходы правильным образом.
Подготовка образцов

Шаг 1: Подготовьте шприцы с одноразовыми иглами и пробирками.
Шаг 2: Пометьте пробирки для образцов генетического материала, указав информацию о пациенте или доноре.
Шаг 3: Наденьте перчатки и приготовьте необходимые реагенты и оборудование.
Шаг 4: Подготовьте образцы генетического материала, такие как кровь, слюна или другие ткани.
Шаг 5: Очистите область сбора образца с помощью спирта или другого антисептика для предотвращения загрязнения.
Шаг 6: Соберите образец с помощью иглы и шприца, обратив внимание на высокую стерильность.
Шаг 7: Передайте образец в подготовленную пробирку и аккуратно закройте ее, избегая загрязнений.
Шаг 8: Повторите процедуру для каждого образца генетического материала.
Шаг 9: Поместите пробирки в холодильник или передвижной контейнер для хранения до момента анализа.
Шаг 10: Запишите подробную информацию о каждом образце, включая дату сбора и способ хранения.
Важно помнить о высокой стерильности и аккуратности при подготовке образцов, чтобы избежать ошибок и получить надежные результаты анализа ЦМВ-ПЦР.
Извлечение нуклеиновой кислоты
Для проведения извлечения нуклеиновой кислоты из биологического материала, такого как кровь или слюна, существует несколько методов. Один из самых распространенных методов - метод фенол-хлороформной экстракции.
Процесс извлечения нуклеиновой кислоты начинается с лизиса клеток и разрушения оболочек вирусных частиц. Затем проводится обработка пробирки с материалом специальными реактивами, которые способствуют разделению компонентов биологического материала.
Полученная смесь затем подвергается центрифугированию, в результате которого нуклеиновая кислота отделяется от других компонентов. На этом этапе важно быть осторожным и не допускать переноса загрязнений, так как они могут негативно повлиять на качество и точность последующих анализов.
Изолированную нуклеиновую кислоту можно сохранить при низкой температуре, чтобы она не деградировала до проведения дальнейших тестов. Также возможно проведение качественного контроля полученной нуклеиновой кислоты для подтверждения ее наличия и исключения возможности попадания посторонних загрязнений.
Базовые знания и навыки в извлечении нуклеиновой кислоты являются ключевыми для эффективного проведения ПЦР на наличие ЦМВ. Правильное извлечение нуклеиновой кислоты может повысить чувствительность и специфичность теста, что важно для правильной диагностики и лечения.
Подготовка реакционной смеси
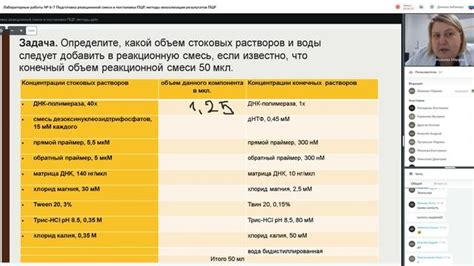
Для проведения ПЦР-анализа на наличие ЦМВ необходимо подготовить реакционную смесь, которая будет содержать все необходимые компоненты для успешного проведения реакции.
Для подготовки реакционной смеси потребуются следующие компоненты и реагенты:
- ПЦР-пробы: специально разработанные праймеры, которые позволяют специфически амплифицировать участки ЦМВ-ДНК;
- Шаблон ДНК: образец ДНК, содержащий ЦМВ-ДНК;
- дезоксирибонуклеотиды (dNTPs): мономеры, из которых строится новая ДНК;
- теплостабильный фермент ДНК-полимераза: фермент, катализирующий реакцию амплификации ДНК;
- буфер для ПЦР: раствор, оптимально поддерживающий условия проведения реакции;
- дополнительные реагенты: такие, как дополнительные ионы (например, магний), добавляемые для оптимизации условий реакции.
Для подготовки реакционной смеси следуйте инструкциям производителя использованных вами ПЦР-компонентов и реагентов. Обычно смесь приготовляют в эппендорф-трубках или в специальных ПЦР-пластинках, следуя рекомендациям по объему каждого компонента.
Важно помнить, что при подготовке реакционной смеси необходимо соблюдать стерильность и использовать реагенты и пробы, которые не содержат ДНК ЦМВ-положительных образцов, чтобы исключить возможность контаминации реакции. Также важно проводить все манипуляции на сухих льдах или в термоблоках с льдом для сохранения стабильности реагентов.