Перекись водорода - это химическое соединение из двух атомов водорода и двух атомов кислорода (H2O2), которое обычно пролгает разложение через открытие одной из своих кислородных молекул, в результате чего образуется вода и освобождается кислород. Почему же это происходит?
Ответ на этот вопрос кроется во внутренней структуре перекиси водорода. Молекула H2O2 очень нестабильна, так как имеет слишком большую энергию, и старается избавиться от этого избытка энергии. Начавшиеся реакции разложения позволяют перекиси водорода достичь более стабильного состояния и уравновесить ее энергетическую систему.
Вода, которая образуется в результате разложения перекиси водорода, значительно более стабильна и имеет меньшую энергию по сравнению с H2O2. Это означает, что разложение перекиси водорода в воду освобождает избыток энергии, который ранее содержался в молекуле H2O2. Кислород, в свою очередь, высвобождается в газообразной форме.
Перекись водорода: причины разложения в воде

Разложение перекиси водорода в воде вызвано ее химической реакцией с водой. Эта реакция, называемая аутокаталитическим разложением, происходит при участии катализатора, который может быть присутствовать в воде или добавлен в него. Катализатор ускоряет разложение перекиси водорода на молекулу воды и кислорода.
Основными причинами разложения перекиси водорода в воде являются:
- Температура: Повышение температуры ускоряет разложение перекиси водорода. При понижении температуры реакция замедляется или останавливается полностью.
- Концентрация перекиси водорода: Высокая концентрация перекиси водорода увеличивает скорость разложения воды, поскольку больше молекул будет сталкиваться и реагировать с катализатором.
- Кислород: Присутствие кислорода также ускоряет разложение перекиси водорода. Воздух особенно влияет на эту реакцию.
Разложение перекиси водорода в воде может приводить к образованию взрывоопасных смесей, поэтому необходимо соблюдать предосторожность при работе с ней. Также важно избегать контакта перекиси водорода с металлическими предметами или сильными окислителями, так как это может вызвать опасную реакцию.
Молекулярная структура перекиси водорода
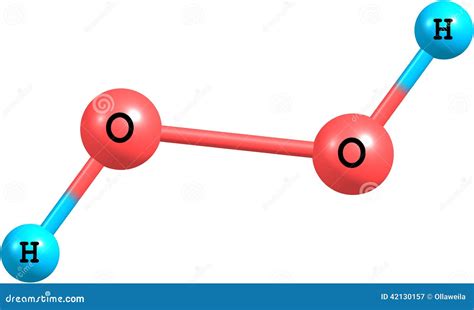
Молекулы перекиси водорода могут существовать в двух основных формах - "плоской" и "гибридизованной". В "плоской" молекулярной форме два атома кислорода объединены с двумя атомами водорода в одной плоскости, образуя угол 104,5 градуса. Эта форма характерна для перекиси водорода в газообразном состоянии или при низких температурах.
При повышенных температурах или в жидком состоянии молекулы перекиси водорода принимают "гибридизованную" структуру, в которой атомы кислорода и водорода находятся в одной плоскости, но угол между атомами водорода и кислорода становится равным 90 градусам. Эта форма обладает большей энергией, что способствует разложению перекиси водорода.
Молекулы перекиси водорода обладают высокой реактивностью, поскольку атомы кислорода в них содержат необычайно высокий потенциал окисления. Это позволяет перекиси водорода быть мощным окислителем, что является причиной ее способности быстро разлагаться при взаимодействии с различными веществами, включая воду.
Разложение перекиси водорода в воде происходит в результате реакции, при которой атомы кислорода перекиси вступают во взаимодействие с атомами водорода воды, образуя молекулы воды и свободные радикалы, такие как HO• (гидроксильный радикал).
Процесс разложения перекиси водорода в воде

Перекись водорода разлагается в воде благодаря присутствию фермента каталазы. Каталаза является белковым катализатором, который ускоряет химическую реакцию разложения перекиси водорода на воду и кислород.
Процесс разложения перекиси водорода в воде можно описать следующей реакцией:
2H2O2 → 2H2O + O2
Каталаза обеспечивает разделение молекул перекиси водорода на две молекулы воды и одну молекулу кислорода. Кислород выделяется в виде газа и может быть виден в виде пузырьков, всплывающих на поверхности воды при разложении перекиси водорода.
Этот процесс разложения активизируется при воздействии тепла, света или специфических химических добавок.
Вода, образовавшаяся в результате разложения перекиси водорода, несет в себе дополнительный кислородный атом, что позволяет использовать ее в качестве окислителя в различных химических процессах и реакциях.