Ковалентная неполярная связь и ионная связь – два различных типа химических связей, которые играют важную роль в образовании молекул и соединений.
Ковалентная неполярная связь возникает между двумя неполярными атомами, когда они делят электроны между собой. В такой связи оба атома равноценны и притягивают электроны с одинаковой силой. Поэтому ковалентная неполярная связь взаимодействия двух неполярных атомов характеризуется отсутствием электростатического взаимодействия и заряда.
С другой стороны, ионная связь образуется между атомом, от которого отщепляется или присоединяется электрон, и атомом, получившим/отдавшим электрон. Ионная связь может возникать между различными атомами, а их разность в электроотрицательности будет определять степень полярности связи.
Ковалентная неполярная связь и ионная связь: различия
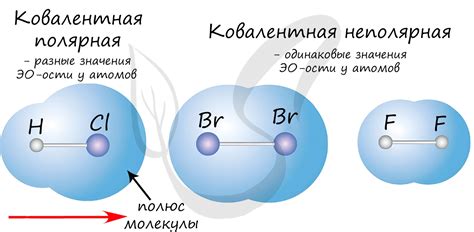
Ковалентная неполярная связь возникает между неполярными атомами, когда они делят пару электронов равномерно между собой. В результате образуется общая область электронной плотности, которая удерживает атомы вместе. Эта связь характеризуется равной электронной плотностью и отсутствием полярности.
Примером ковалентной неполярной связи может служить молекула кислорода (O2). В этой молекуле два атома кислорода делят пару электронов равномерно, образуя общую область электронной плотности и неполярную связь.
Ионная связь возникает между двумя атомами, один из которых является электроотрицательным, а другой – электроположительным. В этом типе связи один атом отдает электрон(ы), становясь положительно заряженным ионом (катионом), а другой атом получает электрон(ы), становясь отрицательно заряженным ионом (анионом). Ионы притягиваются друг к другу благодаря электростатическим силам притяжения.
Примером ионной связи может служить хлорид натрия (NaCl). В этом соединении натрий (Na) отдает электрон хлору (Cl), образуя положительно заряженный ион Na+ и отрицательно заряженный ион Cl-. Эти ионы притягиваются друг к другу, образуя кристаллическую решетку ионного соединения.
Таким образом, различия между ковалентной неполярной связью и ионной связью обусловлены разными способами разделения и передачи электронов между атомами. Ковалентная неполярная связь характеризуется равным делением электронов, тогда как ионная связь возникает при переносе электронов от одного атома к другому. Эти различия определяют различное поведение и свойства соединений, образованных этими типами связей.
Сущность связей

Связи в химии представляют собой энергетические связи, которые удерживают атомы в молекуле вместе. В зависимости от электронного состояния атомов, можно выделить два основных типа связей: ковалентные неполярные и ионные.
Ковалентная неполярная связь возникает между двумя атомами, которые равномерно делят пару электронов. Это означает, что оба атома имеют одинаковую электроотрицательность и равное притяжение к электронам. Такая связь является симметричной и не имеет полярности, что означает, что электроотрицательность атомов не создает разницу в заряде между ними.
Ионная связь возникает между атомами, которые имеют значительную разницу в электроотрицательности. В данной связи один атом отдает электрон(ы), становясь положительно заряженным (катионом), а другой атом принимает электрон(ы), становясь отрицательно заряженным (анионом). Такое перераспределение электронов создает у атомов различные заряды и привлекательное взаимодействие между ними.
| Тип связи | Характеристики связи |
|---|---|
| Ковалентная неполярная связь | Два атома равномерно делят пару электронов |
| Ионная связь | Перераспределение электронов между атомами с различными зарядами |
Представители

Ковалентная неполярная связь характерна для соединений, в которых атомы одного и того же элемента образуют молекулы. Такие молекулы состоят из неполярных ковалентных связей.
Примерами представителей ковалентной неполярной связи являются молекулы кислорода (O2), азота (N2), водорода (H2) и метана (CH4). В этих молекулах электроны общего пользования равномерно распределены между атомами, что делает связь неполярной.
Ионная связь, в отличие от ковалентной неполярной, образуется между атомами разных элементов, которые обладают разными электроотрицательностями. В результате переноса или передачи электронов возникают положительные и отрицательные ионы, создавая электростатические притяжения между ними.
Молекулы, состоящие из ионных связей, называются ионными соединениями или солями. Примерами представителей ионной связи являются хлорид натрия (NaCl), карбонат кальция (CaCO3), сульфат железа (FeSO4) и фосфат аммония (NH4+PO43-).
Образование связей
Ковалентная неполярная связь образуется, когда два атома делят пару электронов. В такой связи электроны равномерно распределены между двумя атомами. Обычно образование ковалентной связи происходит между атомами одного и того же элемента или атомами с похожей электроотрицательностью.
Ионная связь образуется, когда один атом полностью передает один или несколько электронов другому атому. В результате образуется положительный ион – катион и отрицательный ион – анион. Образование ионной связи происходит между атомами с различной электроотрицательностью.
Таким образом, ключевое отличие между ковалентной неполярной и ионной связями заключается в способе образования. В ковалентной связи электроны делятся между атомами, а в ионной связи один атом отдает электроны другому атому.
Полярность связей

Ковалентные неполярные связи и ионные связи имеют отличающуюся степень полярности между связующими атомами.
Ковалентная неполярная связь образуется между двумя атомами с одинаковым электроотрицательностью или близкими значениями электроотрицательности. В такой связи электроны между атомами делятся равномерно, что приводит к отсутствию зарядовых разделений и полярности молекул.
С другой стороны, ионная связь образуется между атомами с значительной разницей в электроотрицательности. В такой связи один атом, обладающий большей электроотрицательностью, привлекает электроны к себе сильнее, что создает положительный заряд у одного атома и отрицательный заряд у другого. Такие зарядовые разделения делают связь полярной.
Полярность связей может быть самой разной степени, она зависит от разницы электроотрицательности между атомами. Чем больше разница, тем больше полярность связи. Если разница электроотрицательности составляет более 1,7, то связь считается ионной. Если разница ниже этого значения, то связь может быть ковалентной неполярной или ковалентной полярной.
Силы связи

Ковалентная неполярная и ионная связи представляют собой два разных типа химических связей, которые обеспечивают стабильность и прочность межатомных связей в молекулах и кристаллах.
Ковалентная неполярная связь возникает между неполярными атомами и характеризуется равным распределением электронной плотности между связанными атомами. В этом типе связи электроотрицательность атомов, а также их радиусы, практически не отличаются. Силы притяжения электронных облаков двух атомов в ковалентной неполярной связи близки по величине, что обеспечивает их равномерное размещение вокруг обоих атомов.
Ионная связь, с другой стороны, образуется между двумя атомами с значительными различиями в электроотрицательности. В результате этого один из атомов становится положительно заряженным и получает статус иона с положительным зарядом, а другой атом становится отрицательно заряженным ионом. Ионы притягиваются друг к другу силами электростатического притяжения, что обеспечивает стабильность и прочность ионной связи.
Таким образом, силы связи в ковалентной неполярной связи равными и направленными, в то время как в ионной связи силы связи электростатического притяжения. Эти различия определяют химические и физические свойства молекул и кристаллов, образующихся при этих типах связей.
Свойства веществ

| Свойства | Ковалентная неполярная связь | Ионная связь |
|---|---|---|
| Растворимость | В общем случае, ковалентные неполярные вещества растворяются в неполярных растворителях (например, бензоле или гексане), но не растворяются в полярных растворителях (например, воде). | Ионные вещества образуют ионы в растворе и растворяются лучше в полярных растворителях. |
| Точка плавления и кипения | Ковалентные неполярные вещества обычно имеют низкую точку плавления и кипения. Например, молекулы газов, таких как азот и кислород, образуют ковалентные неполярные связи и обладают низкой температурой плавления и кипения. | Ионные вещества обычно имеют высокую точку плавления и кипения. Например, натрий хлорид (обычная соль) имеет высокую температуру плавления и кипения из-за сильных ионных связей. |
| Проводимость электричества | Ковалентные неполярные вещества обычно не проводят электрический ток, так как электроны не могут свободно двигаться по всей структуре. | Ионные вещества, в растворе или расплаве, способны проводить электрический ток, так как свободные ионы могут передвигаться. |
| Реакционная активность | Ковалентные неполярные вещества обычно имеют меньшую химическую реакционную активность по сравнению с ионными веществами. | Ионные вещества обычно имеют большую химическую реакционную активность, так как ионы более склонны к образованию химических связей. |