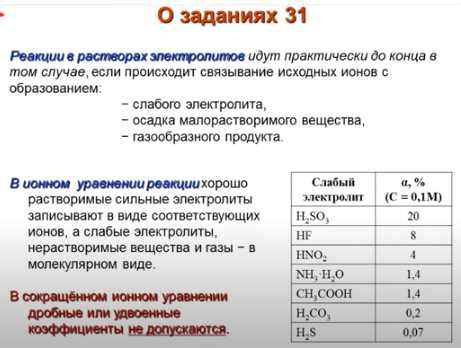
Fe(OH)3 - это неорганическое соединение, представляющее собой гидроксид железа. При нормальных условиях оно является красновато-желтой кристаллической порошокой, нерастворимой в воде. Однако, при нагревании Fe(OH)3 происходят интересные химические реакции, в результате которых изменяются его свойства.
Во-первых, при нагревании Fe(OH)3 происходит его декомпозиция, то есть разложение на составные части. При этом образуются два основных вещества - оксид железа (Fe2O3) и водяной пар (H2O). Данная реакция можно представить следующим уравнением:
2Fe(OH)3 → Fe2O3 + 3H2O
Таким образом, при нагревании Fe(OH)3 образуется оксид железа и водяной пар. Данный процесс является важной химической реакцией, которая может использоваться в различных технологических процессах и промышленности.
Что произойдет при нагревании гидроксида железа(III)?

При нагревании гидроксида железа(III) происходит процесс декомпозиции, в результате которого образуется оксид железа(III) и водяной пар.
Уравнение реакции выглядит следующим образом:
| Fe(OH)3(тв) → | Fe2O3(тв) + 3H2O(г) |
Температура, при которой происходит процесс декомпозиции гидроксида железа(III), зависит от условий проведения реакции. Обычно она начинается при температуре около 200 °C.
В результате нагревания гидроксида железа(III) образуется твёрдый продукт - оксид железа(III), который имеет красно-коричневую окраску и широко применяется в промышленности и других отраслях народного хозяйства.
Исходное вещество

В исходном состоянии, Fe(OH)3 представляет собой темно-коричневый осадок, образующийся при соединении ионов железа(III) Fe3+ и ионов гидроксила OH-. Он обладает кристаллической структурой и малорастворим в воде.
Соединение Fe(OH)3 не имеет конкретную плотность или плавление, так как оно непрямоугольной структуры и является аморфным.
Fe(OH)3 также известен под названием гидроокись железа(III) или гидроксид железа(III). Он может появляться в природных формах, таких как минерал Гематит.
Декомпозиция гидроксида железа(III)

- При нагревании Fe(OH)3 его молекулы начинают разлагаться.
- Происходит образование молекул воды (H2O) и оксида железа(III) (Fe2O3):
- 4 Fe(OH)3 -> 2 Fe2O3 + 6 H2O
Таким образом, при нагревании гидроксида железа(III) образуется оксид железа(III) и молекулы воды.
Образование оксида железа(III)

При нагревании Fe(OH)3 происходит декомпозиция соединения с образованием оксида железа(III), Fe2O3.
Уравнение реакции выглядит следующим образом:
2 Fe(OH)3 → Fe2O3 + 3 H2O
Оксид железа(III) обладает химической формулой Fe2O3 и является темно-красным порошком. Он является оксидом трехвалентного железа и обладает высокой устойчивостью в окружающей среде.
Оксид железа(III) широко используется в промышленности, в том числе в производстве сплавов, катализаторов, пигментов и магнитных материалов. Он также является важным компонентом в производстве стекла, керамики и красок.
Изменение цвета вещества

При нагревании Fe(OH)3 происходит изменение цвета вещества. Исходный гидроксид железа имеет зеленоватую или желтоватую окраску, однако под воздействием тепла происходит дегидратация соединения и образование окиси железа(III) Fe2O3. Изменение в окраске связано с изменением структуры решетки кристаллической решетки и электронной конфигурации атомов железа.
Fe2O3 имеет характерную красную или коричневую окраску, именуемую красной глиной или ржавчиной. Этот красно-коричневый цвет является одним из самых распространенных цветов оксидов железа. Он обусловлен оптическими свойствами Fe2O3, в частности поглощением и отражением видимого света в диапазоне длин волн от 620 до 750 нм.
Влияние нагревания на структуру гидроксида железа(III)
Нагревание Fe(OH)3, или гидроксида железа(III), приводит к его термическому разложению. При этом происходит удаление молекул воды, из которых состоит гидроксид, и образование оксида железа(III), Fe2O3.
Процесс нагревания гидроксида железа(III) включает в себя несколько стадий. Сначала при нагревании до температуры около 200°C происходит выделение воды, так как молекулы воды в гидроксиде связаны нестабильными слабыми связями. Остатки гидроксида образуют оксид низкого железа(III), FeOOH, при этом структура меняется, а кристаллы становятся менее равномерными и упорядоченными.
Дальнейшее нагревание до температуры около 300-400°C вызывает образование оксида железа(III), Fe2O3, так как вторая молекула воды выделяется из оксида низкого железа(III). В результате структура гидроксида полностью разрушается, а образующийся оксид железа(III) имеет кристаллическую структуру.
Таким образом, нагревание гидроксида железа(III) приводит к его переходу в оксид железа(III) с изменением структуры и свойств. Этот процесс играет важную роль в различных промышленных процессах, таких как производство красок, керамики и др.