Орбиталом называют регион вокруг атомного ядра, в котором имеется наибольшая вероятность обнаружить электрон. В квантовой механике орбиталы описывают поведение электронов в атомах и молекулах.
В атомах можно выделить различные типы орбиталей, которые обладают разными формами и энергиями. Всего существует четыре основных типа орбиталей: главные (s, p, d, f). Каждый тип орбиталей задается своими квантовыми числами, которые определяют его энергию, форму и ориентацию в пространстве.
Орбитали s имеют форму сферы и могут содержать два электрона. Главные орбитали s находятся на разных уровнях энергии и более удалены от ядра, чем орбитали p.
Орбитали p имеют форму шарового кольца, где каждое кольцо соответствует определенной плоскости. Каждая плоскость орбитали p может содержать до шести электронов. Всего существует три плоскости p – px, py и pz, которые ориентированы вдоль осей координат x, y и z.
Орбитали d, имеющие форму двухконусовых кольцевых полостей, могут содержать до десяти электронов. Орбитали d имеют различные формы и ориентации в пространстве.
Орбитали f имеют более сложную форму и ориентацию, чем орбитали d. Они представляют собой различные комбинации эллипсов и искривленных конусов. Орбитали f могут содержать до четырнадцати электронов и находятся на более высоких уровнях энергии.
Орбиталы: основные аспекты и их разновидности

Орбитали могут иметь различную форму и размер, что зависит от их энергетического уровня и квантовых чисел. Существует несколько типов орбиталей:
1. s-орбитали: имеют форму сферы и состоят из одной подорбитали. У каждого энергетического уровня может существовать одна s-орбиталь.
2. p-орбитали: имеют форму двуполостного пингвина и состоят из трех подорбиталей, направленных по осям координат (px, py, pz). На каждом энергетическом уровне существуют три p-орбитали.
3. d-орбитали: имеют более сложную форму и состоят из пяти подорбиталей (dxy, dxz, dyz, dx2-y2, dz2). На каждом энергетическом уровне присутствуют пять d-орбиталей.
4. f-орбитали: имеют еще более сложную форму и состоят из семи подорбиталей. На каждом энергетическом уровне существуют семь f-орбиталей.
Каждая орбиталь имеет свою энергию, а энергетические уровни орбиталей выражаются в квантовых числах. Орбитали заполняются электронами согласно принципу заполнения орбиталей, где сначала заполняются орбитали с более низкой энергией.
Орбиталы: определение и функциональное значение
Орбиталы различаются по форме и энергии. Форма орбиталей зависит от основных квантовых чисел: главного (n), орбитального (l) и магнитного (m). Главное квантовое число определяет энергию орбитали, орбитальное квантовое число - форму орбитали, а магнитное квантовое число - ориентацию орбитали в пространстве.
Существуют следующие типы орбиталей:
- С-орбитали: s-орбитали имеют форму сферы и являются ближайшими к ядру. Они обладают наименьшей энергией и диапазоном резонансности. s-орбитали встречаются в любом атоме или молекуле.
- P-орбитали: p-орбитали имеют форму двухлопастного цветка и ориентированы вдоль осей x, y и z. Они имеют большую энергию по сравнению с s-орбиталями и могут участвовать в химических связях.
- D-орбитали: d-орбитали имеют сложную форму и могут быть ориентированы по отношению к осям x, y и z. Они обладают еще большей энергией, чем p-орбитали, и могут быть заняты электронами только после заполнения s- и p-орбиталей.
- F-орбитали: f-орбитали являются самыми сложными по форме и ориентации. Они имеют очень высокую энергию и заполняются только после заполнения s-, p- и d-орбиталей.
Орбитали имеют огромное значение для химической связи и реакций, так как они определяют структуру и свойства вещества. Изучение орбиталей помогает понять, как происходят химические реакции, почему некоторые молекулы более устойчивы, а другие - более реакционноспособны. Также орбитали позволяют предсказывать возможность образования химических связей и предсказывать физические и химические свойства веществ.
Сферические орбитали: особенности и строение
Орбитали представлены математическими функциями волновой функции, которые описывают состояние электрона. Для сферических орбиталей важны два квантовых числа - главное квантовое число (n) и магнитное квантовое число (l). Главное квантовое число определяет энергию электрона, а магнитное квантовое число указывает на форму орбитали.
Сферические орбитали соответствуют значениям l=0. Они имеют вид плотной сферы, радиус которой зависит от главного квантового числа. Чем больше значение n, тем дальше от ядра находятся орбитали.
Такие орбитали направлены во все стороны и не имеют определенной ориентации в пространстве. Их формы можно представить как "облака" вероятности на определенном расстоянии от ядра атома.
| Главное квантовое число (n) | Форма орбитали |
|---|---|
| 1 | Сферическая |
| 2 | Сферическая |
| 3 | Сферическая |
Сферические орбитали играют важную роль в химии, поскольку их формы определяют вероятность нахождения электрона в определенной области пространства вокруг атомного ядра. Это позволяет понять структуру и свойства атомов и молекул и объяснить их химическое поведение.
Важно отметить, что сферические орбитали - это приближенные модели, и фактическое распределение электронов может быть сложнее изображения в виде сферы. Однако сферические орбитали помогают нам представить основные черты пространственного распределения электронов в атоме.
П-орбитали: распространенность и электронная структура

П-орбитали наиболее распространены в атомах и молекулах, так как они являются более высокоэнергетическими и имеют большую вероятность нахождения электрона вокруг атомного ядра. Каждая п-орбиталь может вмещать максимум два электрона, принадлежащих разным спиновым состояниям.
Электронная структура атомов и молекул определяется заполнением п-орбиталей электронами. В атомах, например, электроны заполняют п-орбитали по принципу запрета Паули, согласно которому в каждой орбитали может находиться не более двух электронов с противоположными спинами.
Одна из важных особенностей п-орбиталей - их ортогональность друг к другу. П-орбитали описывают движение электрона вдоль осей координат x, y и z, и поэтому не пересекаются в пространстве.
| П-орбиталь | Описание |
|---|---|
| пx | Орбиталь, в которой вероятность нахождения электрона вдоль оси x наиболее высока. |
| пy | Орбиталь, в которой вероятность нахождения электрона вдоль оси y наиболее высока. |
| пz | Орбиталь, в которой вероятность нахождения электрона вдоль оси z наиболее высока. |
В совокупности, п-орбитали позволяют описывать электронную структуру атомов и молекул, а также взаимодействия электронов в различных реакциях и химических процессах.
Д-орбитали: свойства и значения в химии
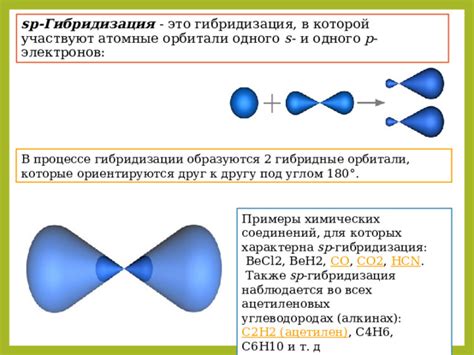
Д-орбитали имеют особенности, которые отличают их от орбиталей других электронных оболочек. В отличие от S, P и F орбиталей, которые могут содержать максимум 2 электрона в каждой орбитали, D-орбитали могут содержать максимум 10 электронов.
Значение D-орбиталей в химии трудно переоценить. Они играют важную роль в образовании химических связей и определяют форму и геометрию молекул. Например, элементы в периоде 4 (титан, ванадий, хром и т.д.) имеют 3D-орбитали, которые участвуют в образовании связей и определяют структуру соединений.
Также D-орбитали имеют спиновые квантовые числа +/-1/2, что значит, что они способны вращаться вокруг своей оси и обладают магнитными свойствами. Эти свойства D-орбиталей используются во многих областях химии, включая катализ и магнитные материалы.
Ф-орбитали: роль в молекулярных соединениях
Ф-орбитали играют важную роль в понимании химической связи и свойств молекул. Они позволяют предсказать форму молекулы, распределение электронной плотности и химическую реакцию.
Ф-орбитали обладают симметрией, что позволяет определить их по математическим уравнениям. Они также имеют определенную форму и размер, которые определяются энергией электрона и его набором квантовых чисел.
Ф-орбитали могут быть заполнены электронами, образуя пары или несвязанные электроны. Это определяет химические свойства молекулы и ее реакционную способность.
Ф-орбитали часто используются для описания межатомных связей в молекулах и межмолекулярных взаимодействий. Они помогают объяснить структуру и свойства различных химических соединений, включая органические и неорганические вещества.
Таким образом, ф-орбитали играют важную роль в химической науке, позволяя исследовать и понимать свойства молекул и их взаимодействия.
Орбитальный момент: физическое понятие и применение
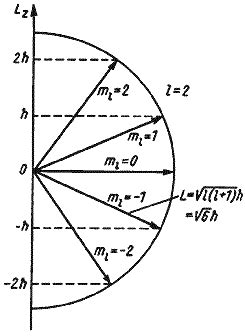
Орбитальный момент электрона связан с его квантовым состоянием, определенным набором квантовых чисел. Квантовое число момента орбиты определяет форму орбитали и ее ориентацию в пространстве.
Орбитальный момент электрона играет важную роль в химии и физике. Он определяет энергетические уровни атома и связан с возможностью электрона переходить с одного уровня на другой. Такие переходы обуславливают побужденное излучение электромагнитных волн, которое широко применяется в спектроскопии для анализа состава вещества.
Кроме того, орбитальный момент электрона является основой для определения магнитного момента атома и спинового момента электрона. Эти характеристики также играют важную роль в различных областях физики и химии: от электромагнитной теории до оптики и физики твердого тела.
Благодаря орбитальному моменту электрона удается объяснить множество явлений в микромире и создать теоретические модели, которые эффективно описывают строение и свойства атомов и молекул. Это позволяет использовать знания орбитального момента для разработки новых материалов, улучшения производственных процессов и создания новых технологий.
Таким образом, понимание орбитального момента и его применение имеет огромное значение для развития науки и технологии, а также для практического применения в различных отраслях науки и промышленности.