Орбитали – это области пространства, в которых вероятно находятся электроны атома. В зависимости от энергии, орбитали делятся на различные типы и формы. Количество орбиталей в атоме влияет на его химические свойства и поведение во внешней среде.
Определение количества орбиталей в атоме основано на его электронной конфигурации. Электронная конфигурация определяет, на каких энергетических уровнях и в каких орбиталях расположены электроны. Число орбиталей соответствует числу энергетических уровней и обозначается с помощью буквы n. Например, водородовый атом имеет только одну орбиталь, обозначенную как 1s.
Гайды и советы:
- Чтобы определить количество орбиталей в атоме, найдите его электронную конфигурацию. Обратите внимание на число энергетических уровней (значение n) и количество электронов в каждом уровне.
- Количество орбиталей может изменяться в зависимости от заряда атома. Например, для ионов атомов с положительным зарядом число орбиталей может быть меньше, чем для нейтральных атомов.
- Помните, что количество орбиталей в атоме связано с его размером и формой. Большие атомы имеют больше орбиталей, чем маленькие атомы.
Орбитали в атоме: определение и значение
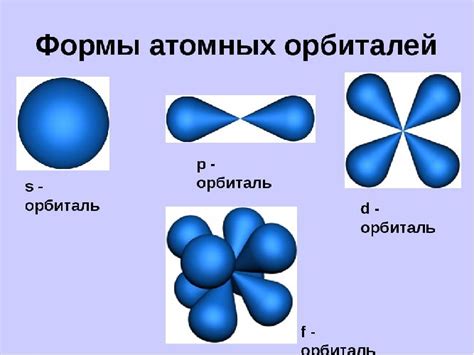
Каждая орбиталь характеризуется своими квантовыми числами, которые определяют ее форму, размер и ориентацию в пространстве. В зависимости от значения главного квантового числа (n), орбитали могут быть различных форм и размеров. Например, орбитали с n=1 имеют форму сферы, а орбитали с n=2 - форму шарлыка.
Количество орбиталей в атоме определяется с помощью второго квантового числа (l). Оно может принимать значения от 0 до n-1. Каждое значение l характеризует подуровень энергии и определяет форму орбитали. Например, l=0 соответствует s-орбитале, l=1 - p-орбитале, l=2 - d-орбитале, и так далее.
Значение орбиталей в атоме заключается в том, что они позволяют описывать вероятное распределение электронов вокруг ядра. В свою очередь, это влияет на химические свойства атома и способность образовывать химические связи.
Более подробное изучение орбиталей и их значений позволяет понять электронную структуру атомов и объяснить различные явления, связанные с химическими процессами и реакциями.
Определение орбиталей в атоме
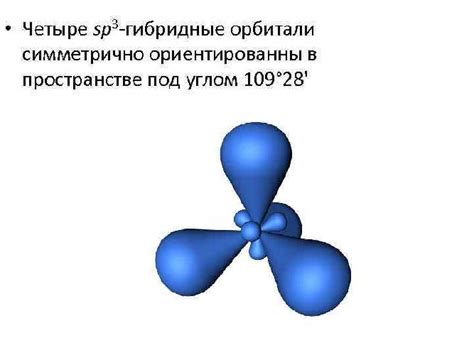
Орбиталь может быть представлена математической функцией, описывающей распределение электронной плотности в пространстве. Форма орбитали зависит от значений квантовых чисел, таких как главное квантовое число, момент импульса и магнитное квантовое число.
В атоме существует несколько типов орбиталей, называемых s, p, d и f. Каждый тип орбитали имеет свою форму и энергетический уровень. Например, орбиталь s представляет собой сферическую область, орбиталь p имеет форму шарового кольца с двумя вытянутыми регионами, орбиталь d имеет форму четырехцветной петли, а орбиталь f - сложную форму с добавочными регионами.
Количество орбиталей в атоме определяется по формуле 2n^2, где n - главное квантовое число. Например, для атома с главным квантовым числом 3 существует 2 * 3^2 = 18 орбиталей. Это означает, что в атоме могут находиться 18 электронов в различных орбиталях.
Понимание орбиталей в атоме является важным для описания химических связей и структуры атомов и молекул. Орбитали помогают определить, какие энергетические уровни электронов могут быть заполнены, а также взаимодействие электронов в различных химических реакциях.
Роль орбиталей в химии и физике
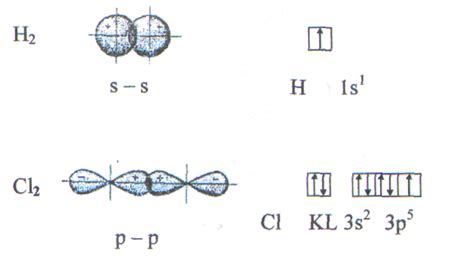
Орбитали играют важную роль в химии и физике, они определяют взаимодействие атомов и молекул, а также электронную структуру вещества.
Орбитали позволяют атомам объединяться в молекулы путем образования химических связей. Вид и расположение орбиталей определяют тип связи: ковалентную, ионную или металлическую. Ковалентная связь возникает при перекрытии орбиталей двух атомов, и электроны в такой связи общие, принадлежат обоим атомам. Ионная связь возникает между атомами с разницей в электроотрицательности, когда один атом отдает электрон, а другой его принимает. Металлическая связь возникает из-за образования электронного облака, в котором электроны свободно перемещаются между атомами металла.
Орбитали также определяют энергию электронов в атоме или молекуле. Чем ниже энергетический уровень орбитали, тем более устойчива эта орбиталь и тем меньше энергии необходимо для возбуждения электрона на этот уровень. Энергетическая структура орбиталей играет роль в химических реакциях, определяет их скорость и направление.
Орбитали также связаны с рассмотрением электронов в рамках квантовой механики. Они определяют вероятность нахождения электрона в определенной области пространства, а также форму электронной оболочки атома или молекулы. Зная форму орбиталей и вероятность нахождения электрона в них, можно предсказывать свойства и поведение вещества. Кроме того, орбитали делятся на подуровни, которые соответствуют различным магнитным квантовым числам, и определяют магнитные свойства вещества.
Как определить количество орбиталей в атоме
Количество орбиталей в атоме зависит от его электронной конфигурации. Электронная конфигурация атома представляет собой способ распределения электронов по энергетическим уровням и подуровням. Чтобы определить количество орбиталей в атоме, нужно знать количество электронов атома и его электронную конфигурацию.
Существует несколько способов определить электронную конфигурацию атома. Один из них - использование периодической системы элементов. Периодическая система элементов показывает количество электронов во внешней оболочке каждого элемента. Последняя цифра в номере элемента соответствует количеству электронов во внешней оболочке. Например, кислород имеет атомный номер 8, что означает наличие 8 электронов в его внешней оболочке. Таким образом, у кислорода есть 2 орбитали в первом энергетическом уровне и 6 орбиталей во втором энергетическом уровне.
Другой способ - использование электронной конфигурации атома. Электронная конфигурация показывает, как электроны распределены по энергетическим уровням и подуровням в атоме. Например, электронная конфигурация кислорода - 1s² 2s² 2p⁴. Это значит, что в первом энергетическом уровне есть 2 электрона, во втором энергетическом уровне есть 2 электрона, а в подуровне p во втором энергетическом уровне - 4 электрона. Таким образом, кислород имеет 2 орбитали в первом энергетическом уровне и 4 орбитали во втором энергетическом уровне.
| Атомный номер | Количество электронов во внешней оболочке | Количество орбиталей в первом энергетическом уровне | Количество орбиталей во втором энергетическом уровне | Количество орбиталей в третьем энергетическом уровне |
|---|---|---|---|---|
| 1 | 1 | 1 | - | - |
| 2 | 2 | 1 | 1 | - |
| 3 | 3 | 1 | 1 | 1 |
| ... | ... | ... | ... | ... |
Таблица показывает количество орбиталей в каждом энергетическом уровне для различных атомных номеров. С помощью этой таблицы можно определить количество орбиталей в атоме, зная его атомный номер.
Зная количество орбиталей в атоме, можно проводить более подробное исследование его свойств и химического поведения. Количество орбиталей определяет, сколько электронов может находиться в атоме и как эти электроны могут взаимодействовать с другими атомами и молекулами.
Гайды и советы по работе с орбиталями

При изучении орбиталей в атоме есть несколько полезных гайдов и советов, которые помогут вам понять их свойства и использовать их в своей работе:
1. Понимание основных типов орбиталей: Основными типами орбиталей являются s, p, d и f орбитали. S-орбитали имеют форму сферы и находятся в центре атома. P-орбитали имеют форму двух областей или лепестков и могут находиться в трех разных ориентациях в пространстве. D-орбитали имеют более сложную форму и могут быть ориентированы в пяти разных направлениях. F-орбитали имеют еще более сложную форму, состоящую из семи областей.
2. Распределение электронов по орбиталям: Заполнение орбиталей электронами происходит согласно правилу Кушинга - Флайта. Согласно этому правилу, орбитали заполняются по возрастанию их энергетического уровня, причем каждая орбиталь должна быть заполнена одним электроном перед тем, как электроны начнут заполнять орбитали с противоположным спином.
3. Роль орбиталей в химических реакциях: Орбитали играют важную роль в химических реакциях, так как они определяют расположение и поведение электронов. Например, орбитали p-симметрии играют важную роль в образовании связей, а орбитали d-симметрии могут участвовать в расщеплении связей или взаимодействии с другими молекулами.
4. Взаимодействие орбиталей: Орбитали могут взаимодействовать друг с другом, образуя связи или пространственные ориентационные эффекты. Например, взаимодействие орбиталей симметричного p-типа может привести к образованию связей двойного или тройного типа.
5. Использование моделей: При работе с орбиталями полезно использовать модели, такие как модель молекулярных орбиталей (ММО), которая позволяет представить орбитали и их взаимодействия в трехмерном пространстве. Это помогает лучше понять структуру и свойства молекул.
Следуя этим гайдам и советам, вы сможете лучше понять и работать с орбиталями в атоме, открывая новые возможности для исследования и практического применения.