Химическая связь - это явление, которое объединяет атомы вещества и определяет его химические свойства. Существуют различные типы химических связей, но наиболее распространены ионная и ковалентная связи. Определение и различие этих связей имеет важное значение для понимания химической структуры и свойств вещества.
Ионная связь образуется между атомами, когда один атом отдает электроны другому атому. Результатом этого процесса являются положительно и отрицательно заряженные ионы, которые притягиваются друг к другу электростатическими силами. В ионной связи происходит полная передача электронов от одного атома к другому. Такая связь обычно формируется между атомами металлов и неметаллов с большой разницей электроотрицательности.
Ковалентная связь, в свою очередь, возникает, когда два атома делят пару электронов между собой. Электроны занимают общую область пространства между атомами и создают электронную пару, которая образует связь между атомами. Ковалентная связь типична для атомов неметаллов или для соединений между атомами неметаллов.
Для определения типа связи используются различные химические и физические методы анализа. Один из таких методов - анализ электроотрицательности атомов. Если разница электроотрицательности между атомами больше заданного значения (обычно 1,7), то связь между атомами считается ионной. В противном случае, если разница электроотрицательности меньше этого значения, связь считается ковалентной.
Связи в химии: ионы или ковалентные соединения
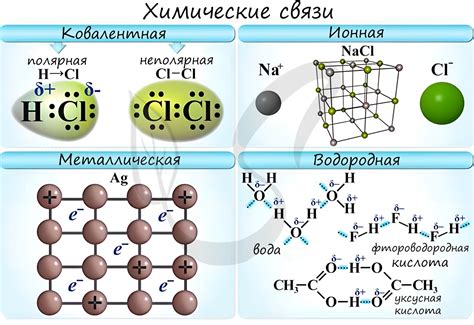
Ионная связь возникает между атомами, когда один или несколько из них передают электроны другому атому, образуя положительно и отрицательно заряженные ионы. Ионные соединения обычно проявляют высокую точку плавления и кипения, а также проводят электрический ток в расплавленном или растворенном состоянии. Основными признаками ионной связи являются разность электроотрицательностей атомов, а также степень их ионизации.
Ковалентная связь возникает, когда два атома делают общее использование электронов. В ковалентных соединениях атомы обычно делят электронные пары, образуя молекулы. Ковалентные соединения обычно имеют более низкую точку плавления и кипения по сравнению с ионными соединениями и могут быть как проводниками, так и непроводниками электричества в зависимости от степени их поляризации и наличия свободных электронов.
Существует несколько методов анализа, позволяющих определить тип связи в химическом соединении. Одним из таких методов является анализ электроотрицательностей атомов. Если разность электроотрицательностей больше 1,7, то связь скорее всего будет ионной. Если разность электроотрицательностей находится в диапазоне от 0,4 до 1,7, то связь будет ковалентной.
Другим методом анализа является анализ структуры химического соединения. Если все атомы в соединении связаны с помощью электронных пар, то связь будет ковалентной. Если в соединении присутствуют положительно и отрицательно заряженные ионы, то это свидетельствует о наличии ионной связи.
| Признак | Ионная связь | Ковалентная связь |
|---|---|---|
| Точка плавления и кипения | Высокие | Низкие |
| Проводимость электрического тока | Высокая в расплавленном или растворенном состоянии | Зависит от степени поляризации и наличия свободных электронов |
| Электроотрицательность атомов | Высокая разность | Низкая разность |
Что такое ионная химическая связь?

Ионная химическая связь обычно образуется между металлами и неметаллами. Металл отдает один или несколько электронов и становится положительно заряженным ионом. Неметалл получает эти электроны и становится отрицательно заряженным ионом.
Примеры веществ, образующих ионную химическую связь, включают поваренную соль (NaCl), где натрий передает электрон хлору, и кальций карбонат (CaCO3), где кальций отдает два электрона и образует катион, а углерод и кислород получают эти электроны и образуют анион.
Ионная химическая связь является сильной связью и обычно приводит к образованию кристаллической решетки, так как ионы пристыковываются друг к другу. Вода, кислород и некоторые другие вещества являются исключением, поскольку у них электростатические силы между ионами настолько слабы, что они образуют молекулярную решетку вместо кристаллической.
Признаки ионной связи

Существуют несколько признаков, которые помогают определить наличие ионной связи:
- Наиболее очевидный признак – образование ионных соединений между металлами и неметаллами. Металлы обычно отдают электроны, образуя положительные ионы, а неметаллы принимают электроны, образуя отрицательные ионы. Ионные соединения также образуются между металлами с несколькими электронами на внешней оболочке и неметаллами с несколькими свободными местами для электронов.
- Полярность связи также может указывать на ионную связь. Ионная связь характеризуется значительным разделением зарядов между атомами, что приводит к образованию полярной связи.
- Соединения, обладающие высокой температурой плавления и кипения, часто являются ионными. Это связано с тем, что для разрыва ионной связи требуется значительная энергия.
- Ионные соединения обычно обладают хорошей растворимостью в воде и других полярных растворителях. Это происходит из-за притяжения положительных и отрицательных ионов в растворе.
- В решетке ионного соединения ионы располагаются в определенном порядке, образуя геометрическую структуру. Это также является одним из признаков ионной связи.
Определение ионной связи может быть полезным для понимания химического поведения веществ, а также помогает предсказывать и объяснять их физические свойства и реакционную способность.
Что такое ковалентная химическая связь?

В ковалентной связи электроны принадлежат обоим атомам и удерживаются их ядрами. Ковалентная связь возникает, когда каждый атом вносит в связь по одному электрону. В результате обмена электронами образуется электронная оболочка молекулы, состоящая из общих попарных электронов.
Ковалентная связь может быть полярной или неполярной, в зависимости от разности электроотрицательности атомов, образующих связь. В полярной ковалентной связи электроны проводимости перераспределяются неравномерно, что приводит к образованию диполя, а в неполярной связи электроны проводимости распределены равномерно.
Методы анализа ковалентной связи включают изучение электроотрицательности атомов, анализ геометрии молекулы, а также применение техник, таких как спектроскопия и рентгеноструктурный анализ.
| Признаки ковалентной связи | Ионная связь | Ковалентная связь |
|---|---|---|
| Обмен электронами | Да | Да |
| Образование общих пар электронов | Нет | Да |
| Электроотрицательность атомов | Разная | Разная или одинаковая |
| Распределение электронов проводимости | Неравномерное | Равномерное или неравномерное |
Признаки ковалентной связи
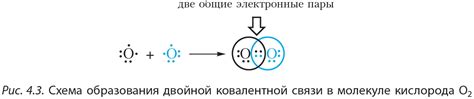
Ковалентная связь возникает между атомами, когда они делят электроны, чтобы достичь стабильной электронной конфигурации. Важно знать, какие признаки можно использовать для определения ковалентной связи.
Основными признаками ковалентной связи являются:
| Признак | Описание |
|---|---|
| Общая электронная конфигурация | В ковалентных соединениях атомы обменивают электроны, чтобы обрести октет (или двойную октетную структуру у элементов 3-го периода и выше). Это приводит к стабильной электронной конфигурации и образованию сильной ковалентной связи. |
| Длина ионно-радиуса | Ковалентная связь характеризуется более короткими расстояниями между атомами, чем в ионной связи. Это связано с тем, что электроны в ковалентной связи распределены между двумя атомами. |
| Электроотрицательность | В ковалентной связи атомы имеют сравнимую электроотрицательность, поэтому электроны общей связи более равномерно распределены между атомами. Это отличает ковалентную связь от ионной, где один атом сильно притягивает электроны. |
| Молекулярная геометрия | Ковалентная связь образует молекулы с определенной геометрией. Значение углов и длин связей между атомами в молекуле может помочь определить наличие ковалентной связи. |
Анализ перечисленных признаков позволяет определить химическую связь между атомами в соединении и установить, является ли она ионной или ковалентной.
Методы анализа химических связей

2. Анализ электроотрицательности. Электроотрицательность - это способность атома вытягивать электроны к себе. Если разность электроотрицательностей двух атомов составляет более 1.7, то связь скорее всего является ионной, а если меньше 1.7, то она скорее всего ковалентная.
3. Анализ строения молекулы. Ионные связи обычно образуются между атомами, которые имеют большую разницу в размерах и находятся на разных концах периодической таблицы. Ковалентные связи образуются между атомами с близкими электроотрицательностями и находящимися близко друг к другу в периодической таблице. Анализ строения молекулы может помочь определить характер связи.
4. Анализ реакций образования или разрушения связей. Как ионные, так и ковалентные связи могут образовываться или разрушаться при химических реакциях. Анализ реакций образования или разрушения связей может указать на характер химической связи.
Используя эти методы анализа, химики могут определить, является ли связь ионной или ковалентной. Это важное знание, которое позволяет лучше понять и объяснить химические реакции и свойства веществ.