Энтальпия – это величина, которая характеризует тепловое состояние вещества при определенных условиях давления и температуры. Расчет энтальпии пара является важным шагом при исследовании и проектировании систем, связанных с использованием пара в различных отраслях промышленности.
Определение и расчет энтальпии пара могут быть выполнены с использованием различных легких способов и формул. Одним из таких способов является использование уравнения Клапейрона, которое позволяет рассчитывать энтальпию пара известными параметрами – давлением и температурой.
Уравнение Клапейрона имеет вид:
pV = nRT
где p – давление, V – объем, n – количество вещества, R – универсальная газовая постоянная, T – температура.
Используя данное уравнение и известные параметры, можно определить энтальпию пара. Существуют также специальные таблицы и программы, которые упрощают расчеты энтальпии пара по давлению и температуре, что значительно экономит время и упрощает процесс расчета.
Определение энтальпии пара

Энтальпия пара представляет собой физическую величину, которая определяет количество теплоты, которое необходимо отнять от единицы массы пара при постоянном давлении, чтобы его температура снизилась до нуля градусов Цельсия.
Определение энтальпии пара может быть важным при решении различных инженерных задач, связанных с теплотехникой и парогенерацией. Энтальпия пара зависит от его давления и температуры, и может быть рассчитана с использованием специальных формул и табличных данных.
Одним из простых способов определить энтальпию пара является использование уравнения Клапейрона-Клаузиуса:
H = Cp * (T - T0)
где H - энтальпия пара, Cp - удельная теплоемкость пара при постоянном давлении, T - текущая температура пара, T0 - исходная температура пара.
Значение удельной теплоемкости пара при постоянном давлении можно найти в специальных таблицах или использовать аппроксимационные формулы в зависимости от температуры пара.
Другим способом определить энтальпию пара является использование табличных значений энтальпии, которые доступны для различных сочетаний давления и температуры. Такие таблицы содержат значения энтальпии пара в разных единицах измерения и обычно представлены для широкого диапазона давлений и температур.
Определение энтальпии пара может быть важным при расчетах тепловых процессов, таких как кипение, конденсация, нагрев и охлаждение пара.
Принцип работы
Расчет энтальпии пара основан на применении уравнения Клаузиуса–Клапейрона, которое связывает давление, температуру и объем пара. Это уравнение позволяет определить изменение энтальпии пара при изменении его состояния.
Для определения энтальпии пара по давлению и температуре необходимо знать начальное и конечное состояние пара. В начальном состоянии обычно принимается исходное давление и температура, а в конечном - конечное давление и температура.
Расчет энтальпии пара производится с использованием формулы:
ΔH = (Cp * (T2 - T1)) + ΔV * P1
где ΔH - изменение энтальпии пара, Cp - теплоемкость пара, T2 и T1 - конечная и исходная температуры соответственно, ΔV - изменение объема пара, P1 - исходное давление.
Полученное значение ΔH позволяет узнать, сколько тепла было поглощено или выделено паром при переходе от начального состояния к конечному.
Формула расчета

Для расчета энтальпии пара можно использовать формулу:
H = H0 + Cp(T - T0)
где:
- H - энтальпия пара;
- H0 - энтальпия при стандартных условиях (обычно принимается равной 0);
- Cp - удельная теплоемкость пара;
- T - текущая температура пара;
- T0 - стандартная температура (обычно принимается равной 0).
Эта формула позволяет учесть изменение энтальпии пара при изменении его температуры. Удельная теплоемкость Cp обычно зависит от конкретного вещества, поэтому для разных веществ эта формула может быть различной.
Расчет энтальпии пара по давлению и температуре

Энтальпия пара представляет собой физическую величину, которая показывает количество теплоты, необходимое для превращения единицы вещества из жидкого состояния в газообразное при постоянном давлении.
Для расчета энтальпии пара по давлению и температуре можно использовать уравнение Вант-Хоффа. Это уравнение связывает энтальпию пара с молярными энтальпиями исходного вещества и воды, а также с давлением и температурой.
Уравнение Вант-Хоффа имеет следующий вид:
- ΔH = ΔH0 + R * T * ln(P/П0),
где:
- ΔH - энтальпия пара,
- ΔH0 - молярная энтальпия исходного вещества,
- R - универсальная газовая постоянная (8,314 Дж/(моль·К)),
- T - температура в Кельвинах,
- P - давление пара в Паскалях,
- П0 - стандартное давление (101325 Па).
С помощью данного уравнения можно получить значение энтальпии пара при известных значениях давления и температуры. Коэффициент R является константой, П0 - стандартное давление.
Расчет энтальпии пара по давлению и температуре важен для различных процессов, таких как кипячение, конденсация или плавление. Зная значение энтальпии пара, можно оценить количество теплоты, которое будет поглощено или выделяться при этих процессах.
Учет фазовых состояний
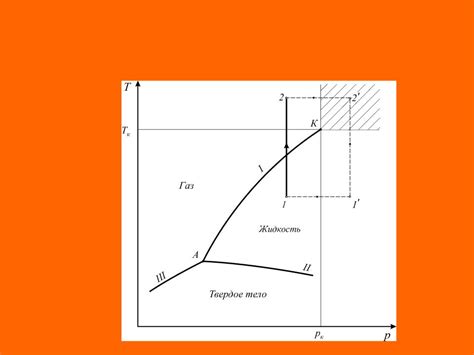
При расчете энтальпии пара по давлению и температуре необходимо учитывать фазовые состояния, которые характеризуются свойствами вещества в разных условиях. Фазовые состояния определяются давлением, температурой и силой притяжения между молекулами.
В основе расчета энтальпии пара лежит понятие состояния насыщенного пара, которое характеризуется равновесием между жидкостью и паром. Насыщенный пар может существовать только при определенной температуре и давлении, называемых температурой и давлением насыщения.
Давление насыщения пара зависит от температуры и определяется фазовой диаграммой. Фазовая диаграмма представляет собой график зависимости давления насыщенного пара от температуры. Для каждой вещества фазовая диаграмма имеет свою специфическую форму.
При расчете энтальпии пара необходимо определить фазовое состояние и использовать соответствующую формулу или аппроксимацию. Для многих веществ существуют специальные уравнения, позволяющие рассчитать энтальпию пара с большой точностью.
Важно также учитывать, что энтальпия пара зависит от температуры и изменяется при изменении фазового состояния. Поэтому при расчете энтальпии пара необходимо учитывать не только начальные условия, но и условия, в которых происходит изменение состояния.
Давление и температура

Давление определяет силу, с которой пар действует на окружающую среду. Оно измеряется в Па (паскалях) или атмосферах. Давление пара зависит от его температуры и объема. При повышении температуры, давление пара также увеличивается.
Температура – это мера средней кинетической энергии молекул вещества. Она измеряется в К (кельвинах) или °C (градусах Цельсия). Увеличение температуры пара приводит к увеличению средней скорости движения его молекул и, соответственно, к повышению энтальпии.
При определении и расчете энтальпии пара по давлению и температуре используются различные формулы, такие как формула Клазиуса-Клаузиуса или уравнение состояния идеального газа. При этом необходимо учитывать физические и химические свойства вещества, из которого образуется пар.
Величина энтальпии пара при заданных давлении и температуре является важным параметром для многих технических процессов, включая производство электроэнергии, химическую промышленность и другие отрасли. Корректный расчет энтальпии пара позволяет оптимизировать эти процессы и повысить их эффективность.