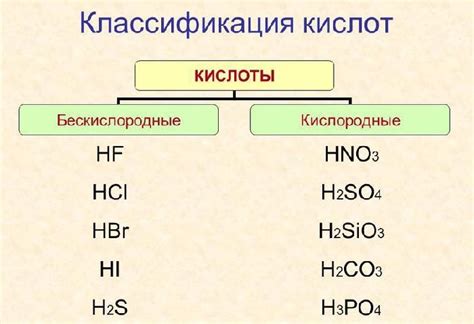
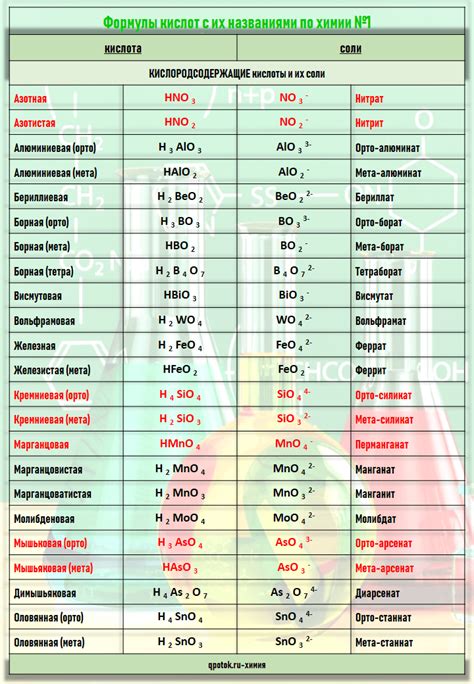
Бескислородные кислоты являются одним из важных классов химических соединений, которые отличаются своими особенностями и свойствами. Они получили свое название благодаря отсутствию кислородного атома в своей структуре. Эти соединения обладают рядом химических свойств, которые делают их полезными в различных областях науки и технологии.
Одной из особенностей бескислородных кислот является их высокая активность и реакционная способность. Это объясняется наличием электронной ненасыщенности в их молекулах, что делает их склонными к реагированию с другими веществами. Благодаря этому, бескислородные кислоты могут служить катализаторами для различных химических реакций или используются в процессах синтеза органических соединений, включая промышленные процессы производства лекарств, пластиков и других веществ.
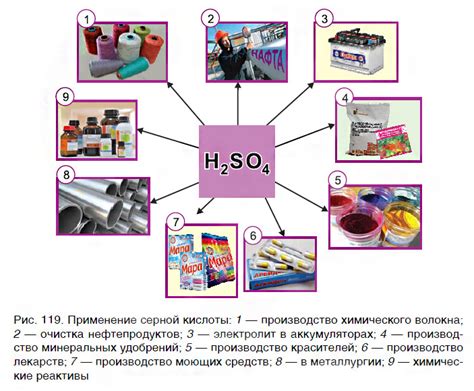
Одним из наиболее широко известных примеров бескислородных кислот является серная кислота (H2SO4). Она широко используется в различных отраслях промышленности благодаря своим уникальным химическим свойствам и способности реагировать с различными органическими и неорганическими веществами. Кроме серной кислоты, к этому классу соединений относятся также фосфорная кислота (H3PO4), перхлоровая кислота (HClO4) и множество других соединений, каждое из которых имеет свои уникальные свойства и области применения.
Бескислородные кислоты в химии: определение, свойства и примеры
Основные свойства бескислородных кислот включают:
- Буферная емкость: Бескислородные кислоты могут сопротивлять изменениям pH путем поглощения добавленных кислотных или щелочных растворов. Это позволяет им поддерживать постоянное окружение для различных процессов.
- Распространенность в организмах: Многие организмы, включая человека, содержат бескислородные кислоты в своих биологических системах. Это выполняет роль в поддержании стабильного pH и регулировании различных физиологических функций.
- Применение в лабораторных условиях: Бескислородные кислоты часто используются в лабораторных условиях для поддержания определенных pH-уровней, например, при проведении реакций или культивировании клеток.
Примеры бескислородных кислот включают фосфатные буферные растворы, ацетатные буферные растворы и триглицериды. Они широко используются в биохимии, молекулярной биологии и других областях научных исследований.
Бескислородные кислоты играют важную роль в поддержании стабильного pH и выполняют множество других функций в химических и биологических системах. Это делает их неотъемлемыми инструментами в химической и биологической науке.
Что такое бескислородные кислоты
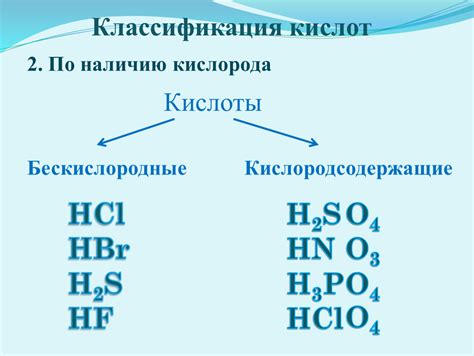
Бескислородные кислоты могут быть органическими или неорганическими соединениями. Они образуются путем замены атомов кислорода в кислотных соединениях на другие элементы. Например, бескислородная серная кислота (H2SO3) и бескислородная фосфорная кислота (H3PO3) являются примерами бескислородных кислот.
Бескислородные кислоты могут обладать различными свойствами и применяться в разных областях. Например, серная кислота широко используется в промышленности для производства удобрений, растворителей и кислотных батарей. Фосфорная кислота используется в производстве пищевых добавок, удобрений и стекла.
Бескислородные кислоты играют важную роль в химических процессах и могут быть использованы в различных областях, от промышленности до медицины. Изучение и понимание свойств и применения бескислородных кислот имеет большое значение для химии и науки в целом.
Определение бескислородных кислот
Бескислородные кислоты образуются при замещении кислородного атома в обычной кислоте другим элементом или группой элементов. Часто этим элементом является сера или азот. Такие замещенные кислоты сохраняют ацидные свойства в результате реакции замещения, при которой кислородная группа заменяется другим атомом или группой.
Бескислородные кислоты широко применяются в органическом синтезе и могут служить прекурсорами для получения разнообразных органических соединений. Они могут быть использованы в процессе селективных функциональных превращений, благодаря своей способности присоединяться к различным соединениям и создавать новые молекулы с желаемыми свойствами.
Свойства бескислородных кислот
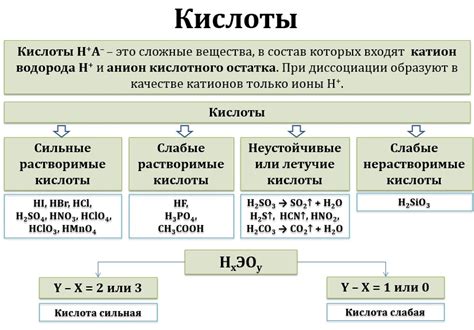
Несмотря на отсутствие кислорода, бескислородные кислоты все равно проявляют некоторые кислотные свойства. Вот некоторые из них:
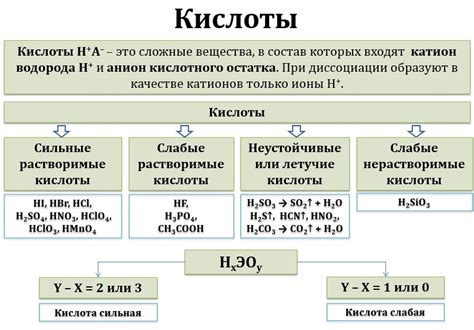
- Кислотность: Бескислородные кислоты могут реагировать с основаниями, образуя соль и воду. Чем больше количество водородных атомов в молекуле кислоты, тем сильнее ее кислотность. Сильные кислоты могут образовывать соли с различными металлами и основаниями.
- Электрофильность: Бескислородные кислоты обладают электрофильными свойствами и могут быть использованы в реакциях замещения, аддиций и элиминаций.
- Способность к образованию ионов: Некоторые бескислородные кислоты могут образовывать ионы в растворе. Это свойство позволяет им участвовать в реакциях, в которых ионы играют важную роль.
- Теплостойкость: Бескислородные кислоты могут обладать высокой теплостойкостью, что делает их полезными в различных промышленных процессах.
Примеры бескислородных кислот включают серную кислоту (H2SO4), фосфорную кислоту (H3PO4) и соляную кислоту (HCl). Они широко используются в промышленности и в лабораторных условиях.
Примеры бескислородных кислот

В химии существует множество различных бескислородных кислот, которые имеют широкий спектр применений. Некоторые из них включают:
| Кислота | Формула | Применение |
|---|---|---|
| Соляная кислота | HCl | Используется в химической промышленности для производства хлорида натрия, пластика и ряда других химических продуктов. |
| Серная кислота | H2SO4 | Широко используется в производстве удобрений, бензина и других химических веществ. Также применяется при очистке металлов и производстве бумаги. |
| Фосфорная кислота | H3PO4 | Используется в производстве удобрений, моющих средств, пищевых добавок и в процессах окрашивания тканей. |
| Уксусная кислота | CH3COOH | Применяется в пищевой промышленности для консервации, а также в производстве лекарств, растворителей и пластиков. |
| Солянокислый калий | KHSO4 | Используется в производстве удобрений, кожи, стекла и других химических продуктов. |
Это только небольшой список бескислородных кислот, которые широко используются в различных областях химической промышленности и научных исследований. Каждая из них имеет свои уникальные свойства и применения, что делает их важными компонентами в многих процессах и продуктах, которые мы используем в повседневной жизни.
Значение бескислородных кислот в химии
Бескислородные кислоты имеют молекулярные формулы общего вида RCOOH, где R - органический радикал или атом водорода. Они получаются путем гидролиза эфиров или окисления альдегидов. Некоторые из самых распространенных бескислородных кислот включают уксусную кислоту, бутановую кислоту, бензойную кислоту и пропановую кислоту.
Бескислородные кислоты обладают различными физическими и химическими свойствами. Они являются слабыми кислотами и могут образовывать соли - карбонаты. Они также обладают выраженной поверхностной активностью и могут использоваться в качестве компонентов детергентов и моющих средств. Кроме того, бескислородные кислоты применяются в органическом синтезе для получения других соединений, таких как альдегиды и кетоны.
Бескислородные кислоты имеют широкий спектр применения в различных областях. Они используются в пищевой промышленности как добавки, в фармацевтике для производства лекарственных препаратов, в текстильной промышленности для обработки тканей и в косметической промышленности для производства косметических средств.
| Примеры бескислородных кислот | Молекулярная формула |
|---|---|
| Уксусная кислота | CH3COOH |
| Бутановая кислота | CH3CH2COOH |
| Бензойная кислота | C6H5COOH |
| Пропановая кислота | CH3CH2COOH |
Использование бескислородных кислот в промышленности
- Производство пищевых добавок: многие бескислородные кислоты используются в качестве консервантов и антиоксидантов в пищевых продуктах. Например, бензоевая кислота (C6H5COOH) используется для увеличения срока хранения пищевых продуктов.
- Производство лекарственных препаратов: некоторые бескислородные кислоты, такие как азотная кислота (HNO3) и серная кислота (H2SO4), используются в производстве лекарственных препаратов. Они могут быть использованы в качестве реагентов или растворителей для синтеза различных активных соединений.
- Производство пластмасс и полимеров: некоторые бескислородные кислоты, такие как ацетонитрил (CH3CN) и стеариновая кислота (C18H36O2), используются в производстве различных пластмасс и полимеров. Они могут быть использованы в качестве растворителей или мономеров для полимеризации.
- Обработка металлов: некоторые бескислородные кислоты, такие как фосфорная кислота (H3PO4) и соляная кислота (HCl), используются в процессах обработки металлов, включая очистку, травление и покрытие поверхности. Эти кислоты могут растворять окислы и нежелательные примеси на поверхности металлов.
- Электроэнергетика: некоторые бескислородные кислоты, такие как сероводородная кислота (H2S) и аммиачная кислота (NH4OH), используются в процессах очистки и обработки газов и нефтепродуктов в электроэнергетической промышленности. Они могут удалять сероводород и другие вредные компоненты из газовых смесей.
Это только несколько примеров использования бескислородных кислот в промышленности. Благодаря своим уникальным свойствам, они нашли широкое применение в различных отраслях, способствуя развитию науки и технологии.
Потенциальные риски и применение бескислородных кислот
Бескислородные кислоты имеют несколько потенциальных рисков при использовании. Первый и наиболее значимый риск связан с их высокой токсичностью. Бескислородные кислоты, такие как галогеноводородные кислоты, могут вызывать ожоги на коже и слизистых оболочках, а также оказывать токсическое воздействие на органы дыхания и нервную систему.
Еще один потенциальный риск связан с их высокой реакционной способностью. Бескислородные кислоты могут легко вступать в химические реакции с различными веществами, что может привести к образованию взрывоопасных смесей или созданию опасного окружающего воздуха.
Однако, несмотря на эти риски, бескислородные кислоты имеют различные применения в промышленности и лабораториях. Например, галогеноводородные кислоты используются при производстве пластмасс, резиновых изделий и фармацевтических препаратов. Большинство бескислородных кислот также используются в качестве реактивов при синтезе органических соединений и анализе веществ в лабораториях.
Важно строго соблюдать все меры безопасности при работе с бескислородными кислотами, такие как ношение защитной одежды, использование специальных средств защиты (например, масок и очков) и проведение работы в хорошо проветриваемых помещениях или специальных вентиляционных системах.