Общие электронные пары – это явление, которое является ключевым для понимания химической связи между атомами. Это концепция, введенная Г.Н.Льюисом, которая устанавливает, что атомы могут обменивать электроны, чтобы достичь наиболее стабильного состояния - октаэдрической конфигурации. Изучение общих электронных пар позволяет нам полностью понять структуру и свойства молекул, а также предсказывать и объяснять химические реакции.
Когда два атома соединяются, они делятся общими электронными парами. Такие пары могут быть представлены точками или черточками включительно кости или им же сочетанием оборотного слога ради эмфатизма. Количество общих электронных пар в молекуле определяет тип химической связи между атомами. Если атомы делят только одну пару электронов, то это называется одинарной связью. При двух общих электронных парах - двойная связь и т.д.
Общие электронные пары также объясняют трехмерную геометрию молекулы. Атомы в молекуле стремятся максимально удалиться друг от друга, чтобы минимизировать электростатическую энергию. Используя общие электронные пары, мы можем определить форму молекулы, включая углы между связями и расстояния между атомами.
Общие электронные пары

Общие электронные пары образуются в результате совместного использования двух атомами электронов. Один электрон принадлежит одному атому, а второй электрон – другому атому. Это позволяет атомам стабилизироваться и образовать молекулу.
Общие электронные пары могут быть связаны с одной или двумя химическими связями между атомами. При одной химической связи образуется одна общая электронная пара, а при двух связях – две общие электронные пары.
Общие электронные пары имеют важное значение в химии. Они определяют форму и структуру молекулы, а также свойства вещества. Количество общих электронных пар в молекуле можно определить с помощью так называемой формальной зарядности атомов.
Общие электронные пары позволяют атомам образовывать устойчивые молекулы и обладать разнообразными свойствами. Изучение этого явления позволяет понять основы химии и молекулярных взаимодействий.
Явление в химии

Общие электронные пары – это пары электронов, которые образуются при образовании химической связи между атомами. В этих парах каждый электрон принадлежит одному из атомов, но он также участвует в образовании связи с другим атомом. Такие пары электронов играют ключевую роль в химических реакциях и определяют форму и геометрию молекул.
Одна известная модель, объясняющая образование общих электронных пар, это теория Вальенса. Согласно этой теории, атомы образуют химические связи путем обмена электронами. Когда два атома приближаются друг к другу, их электронные облака начинают перекрываться. В результате этого образуются общие электронные пары, которые связывают атомы вместе.
Общие электронные пары играют важную роль в определении геометрической структуры молекулы и ее свойств. Например, если молекула имеет две общие электронные пары и две связующие электронные пары, она будет иметь форму метана (CH4), где атом углерода находится в центре, ачетыре атома водорода окружают его вокруг вершин tetrahedron.
Общие электронные пары также могут определять химическую активность молекулы и ее способность к реакциям. Например, общие электронные пары на атоме кислорода в молекуле воды (H2O) делают ее полярной и способной взаимодействовать с другими веществами.
Структура атома и общие электронные пары

Структура атома состоит из ядра, содержащего протоны и нейтроны, и электронной оболочки, на которой находятся электроны. Электроны в атоме расположены на разных энергетических уровнях, которые называются электронными оболочками.
На каждом энергетическом уровне может находиться определенное количество электронов. На внешней электронной оболочке атома обычно находится небольшое количество электронов, которые называются валентными электронами. Валентные электроны отвечают за химические связи и реакции атома.
Одной из основных концепций в химии является понятие общих электронных пар. Общие электронные пары представляют собой пары электронов, которые являются общими для двух атомов в химической связи. Эти пары электронов образуются из валентных электронов атомов, которые делятся между атомами при образовании связи.
Общие электронные пары могут быть представлены либо одной парой электронов (одиночная связь), либо двумя парами электронов (двойная связь), либо тремя парами электронов (тройная связь). Количество общих электронных пар зависит от количества валентных электронов, которые каждый атом может отдать или принять.
Общие электронные пары в связи между атомами обеспечивают стабильность и прочность связи. Они также определяют форму молекулы и ее свойства. Понимание общих электронных пар позволяет предсказывать возможные связи и свойства химических соединений.
Формирование химических связей через общие электронные пары
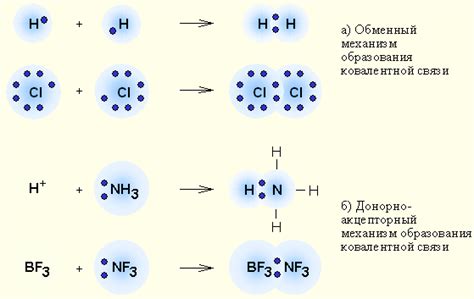
Чтобы понять, что такое общие электронные пары, необходимо иметь представление о строении атома. Атом состоит из ядра, в котором находятся протоны и нейтроны, а также облака электронов, которые обращаются вокруг ядра по различным энергетическим орбиталям.
Электроны находятся в орбиталях парами, а каждая пара содержит два электрона со противоположным спином. Когда два атома пересекаются друг с другом, их электронные орбитали могут перекрыться, образуя так называемые общие электронные пары.
Общие электронные пары могут образоваться между атомами различных элементов, имеющих неполную электронную оболочку. Подобный связывающий механизм в химии позволяет атомам достичь стабильного электронного октаэдра, заполнив все свои энергетические орбитали.
Общие электронные пары можно представить как электронные облака, которые образуются на пересечении электронных орбиталей двух атомов. За счет обмена электронами, атомы могут достичь более стабильного состояния, образуя ковалентные химические связи.
Общие электронные пары определяют характер и силу химической связи между атомами. Количество общих электронных пар в молекуле определяет ее степень насыщенности и химические свойства.
Чтобы наглядно представить общие электронные пары, часто используют модель Льюиса, которая использует знаки «точка» и «черта» для обозначения электронных пар. При этом каждая точка представляет один электрон, а черта обозначает общую электронную пару.
| Химическое соединение | Модель Льюиса |
|---|---|
| Молекула воды (H2O) | O•:H |
| Молекула аммиака (NH3) | N:H• |
| Молекула метана (CH4) | C•:H |
Примеры веществ, содержащих общие электронные пары

1. Аммиак (NH3) - молекула аммиака состоит из азотного атома, который образует три общие электронные пары с водородом. Эти электронные пары создают тройку электронов вокруг азота и определяют форму молекулы.
2. Вода (H2O) - в молекуле воды кислородный атом образует две общие электронные пары с водородом. Эти электронные пары также создают тройку вокруг кислородного атома, определяя угловую форму молекулы.
3. Двуокись углерода (CO2) - в молекуле двуокиси углерода каждый кислородный атом образует две общие электронные пары с углеродом. Эти электронные пары лежат в плоскости молекулы и делают ее линейной.
4. Метан (CH4) - в молекуле метана углеродный атом образует четыре общие электронные пары с водородом. Эти электронные пары образуют тетраэдральную форму молекулы.
Это лишь некоторые из многих примеров веществ, где общие электронные пары играют важную роль в определении их строения и свойств.