В природе существуют три основных состояния вещества: газообразное, жидкое и твердое. Они имеют свои уникальные свойства, обусловленные внутренней структурой молекул и различиями в силе взаимодействий между ними. В данной статье рассмотрим, почему молекулы жидкости притягиваются сильнее, чем молекулы газа.
Один из ключевых факторов, определяющих силу притяжения между молекулами, - это силы Ван-дер-Ваальса. Они возникают из-за временных изменений во взаимном расположении зарядов в молекулах. В отличие от газа, молекулы жидкости находятся ближе друг к другу, поэтому силы Ван-дер-Ваальса вещественнее и сильнее, что обусловливает более высокую силу притяжения между ними.
Еще одним важным фактором в силе взаимодействий молекул жидкости являются силы гидрогенной связи. Эти связи возникают между молекулами, в которых атомы водорода, связанные с отрицательно заряженными атомами, образуют водородные мостики с положительно заряженными атомами других молекул. Благодаря этому, молекулы жидкости сильнее притягиваются друг к другу и имеют более высокие температуры кипения и плавления.
Таким образом, молекулы жидкости притягиваются сильнее молекул газа из-за более сильных сил Ван-дер-Ваальса и гидрогенных связей. Эти притяжения влияют на множество свойств жидкостей, включая их плотность, вязкость и поверхностное натяжение. Понимание этих особенностей жидкостей является важным для многих областей науки и технологии, от химии и физики до биологии и материаловедения.
Сильное притяжение молекул жидкости: причины и последствия
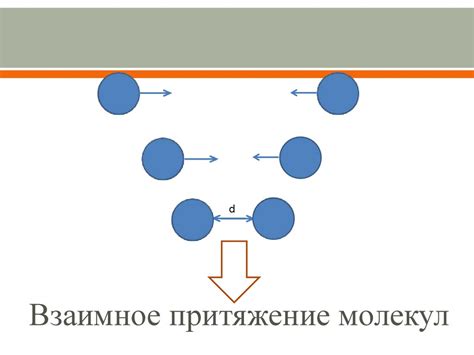
Притяжение молекул жидкости объясняется электростатическими силами и взаимодействием диполей, магнитных полей и других фундаментальных сил. Эти силы проявляются на молекулярном уровне и влияют на поведение жидкостей.
Одним из основных последствий сильного притяжения молекул жидкости является их "сцепление" друг с другом. Это приводит к образованию плотной структуры жидкости, в которой молекулы располагаются близко друг к другу и образуют своеобразную сетку.
Такая плотная структура обеспечивает жидкостям свойства, отличные от газов. Например, жидкости имеют определенный объем и форму, сохраняются в замкнутом сосуде, а также обладают поверхностным натяжением и способностью капиллярного восходящего течения.
Сильное притяжение молекул жидкости также влияет на их плотность и вязкость. Молекулы, притягиваясь друг к другу, уплотняются и обусловливают более высокую плотность по сравнению с газами. Кроме того, притяжение молекул замедляет их движение, что приводит к увеличению вязкости жидкостей.
| Причины | Последствия |
|---|---|
| Электростатическое притяжение молекул | Образование плотной структуры |
| Взаимодействие диполей и других сил | Сохранение формы и объема |
| Поверхностное натяжение | Капиллярное восходящее течение |
| Уплотнение молекул и повышение плотности | Увеличение вязкости |
Молекулы жидкости и газа: в чем их отличия?

Главное отличие молекул жидкости от молекул газа заключается в их силе притяжения. Молекулы жидкости притягиваются друг к другу сильнее, чем молекулы газа. Это происходит из-за наличия межмолекулярных сил притяжения, таких как силы ван-дер-ваальса и водородные связи.
Молекулы жидкости имеют более упорядочено расположение, что позволяет им образовывать относительно близкие связи друг с другом. У молекул газа нет такого сильного взаимодействия, поэтому они могут свободно двигаться и заполнять доступное пространство.
Также молекулы жидкости имеют более высокую плотность, чем молекулы газа, потому что они находятся ближе друг к другу. Это делает жидкость более тяжелой и труднее сжимаемой по сравнению с газом.
Другой важный аспект отличия молекул жидкости от газа - в том, что жидкость имеет определенную форму, в то время как газ не имеет постоянной формы и заполняет все им доступное пространство. Молекулы жидкости способны принять форму контейнера в котором они находятся, под воздействием внешних сил.
Притяжение молекул жидкости: силы взаимодействия
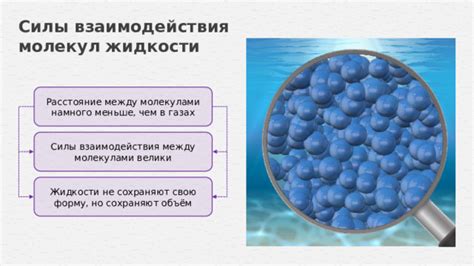
Силы притяжения между молекулами жидкости являются сильнее, чем силы взаимодействия молекул газа. Это обусловлено более плотным расположением молекул жидкости и их более близким расстоянием друг от друга.
Основными типами сил притяжения между молекулами жидкости являются ван-дер-ваальсовы силы и водородные связи. Ван-дер-ваальсовы силы возникают благодаря несимметричному распределению электронной оболочки молекулы, что приводит к возникновению временных диполей. Эти диполи в свою очередь создают вторичные диполи между соседними молекулами, приводя к их притяжению.
Водородные связи являются особым типом межмолекулярных взаимодействий и происходят между молекулами, содержащими атомы водорода, связанными с электроотрицательными атомами (кислород, азот и др.). Водородные связи очень сильны и способны приводить к образованию кластеров молекул жидкости, что придает им устойчивость и определенные физические свойства.
Притяжение молекул жидкости связано не только с их взаимодействием, но и с внешними факторами, такими как температура и давление. При повышении температуры или понижении давления силы притяжения между молекулами жидкости снижаются, что приводит к изменению ее физических свойств, например, кипения и замерзания.
Изучение сил притяжения между молекулами жидкости является важным для понимания структуры и свойств жидкостей, а также для разработки новых материалов с определенными химическими и физическими свойствами.
Влияние межмолекулярных сил на свойства жидкостей
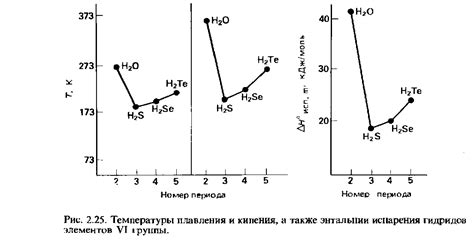
Жидкости обладают рядом особенных свойств, которые объясняются влиянием межмолекулярных сил. Эти силы играют ключевую роль в определении физических и химических свойств жидкостей.
Одной из основных межмолекулярных сил является сила Ван-дер-Ваальса, которая возникает из-за слабого притяжения между молекулами. Эта сила проявляется в большинстве жидкостей и имеет значительное влияние на их свойства. Сила Ван-дер-Ваальса позволяет жидкостям образовывать более плотные структуры и иметь более высокую плотность по сравнению с газами.
Кроме того, межмолекулярные силы влияют на поверхностные явления, такие как капиллярное действие и поверхностное натяжение. Поверхностное натяжение обусловлено притяжением молекул на поверхности жидкости и является причиной образования капель, пузырей и других форм энергетически устойчивых структур.
Межмолекулярные силы и их влияние на свойства жидкостей можно проиллюстрировать на примере воды. Вода обладает высоким коэффициентом поверхностного натяжения и удельным теплом парообразования, что объясняется силами Ван-дер-Ваальса между молекулами воды. Благодаря этим силам вода образует капли и сохраняет водяной пузырьками на различных поверхностях.
Все эти свойства жидкостей, определяемые межмолекулярными силами, имеют важное практическое применение в различных областях, включая фармацевтику, пищевую промышленность и технологию производства материалов. Научное изучение этих сил и их влияния на жидкости продолжается и позволяет создавать новые практические решения и улучшать существующие технологии.
Сильное притяжение молекул жидкости: преимущества и недостатки
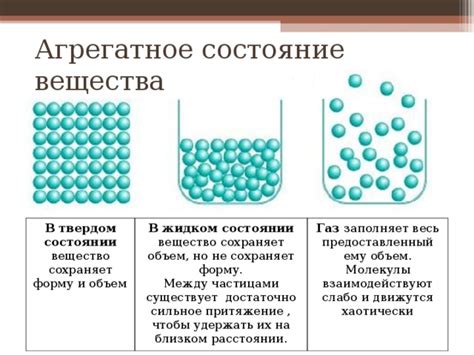
Кроме того, сильное притяжение молекул жидкости обусловливает их способность к коагуляции и формированию поверхностной пленки. Это позволяет жидкостям обладать поверхностным натяжением, благодаря которому они могут образовывать капли и пузырьки на своей поверхности. Также, поверхностное натяжение позволяет жидкостям поддерживать сферическую форму при самосжатии.
Однако, сильное притяжение молекул жидкости также имеет свои недостатки. Во-первых, оно ограничивает свободное движение молекул, что приводит к уменьшению мобильности частиц и увеличению вязкости жидкости. Вязкость определяет сопротивление жидкости при ее потоке и может снижать эффективность транспортировки или перемешивания веществ.
Во-вторых, сильное притяжение молекул жидкости может приводить к образованию внутренней структуры и обусловливать специфическое поведение вещества при низких температурах. Например, в результате сильного притяжения, некоторые жидкости могут образовывать кристаллы при охлаждении, что может затруднять их использование в некоторых технологических процессах.
Таким образом, сильное притяжение молекул жидкости имеет свои преимущества и недостатки, которые полезно учитывать при изучении и применении жидкости в различных областях науки и техники.
Потенциальные области применения жидкостей с сильным взаимодействием молекул

Свойства жидкостей с сильным взаимодействием молекул делают их ценными в различных областях научных и промышленных исследований. Эти свойства позволяют использовать такие жидкости для достижения определенных целей и решения конкретных задач.
Одной из основных областей применения жидкостей с сильным взаимодействием молекул является химическая промышленность. Эти жидкости обладают способностью активно взаимодействовать с другими химическими веществами, обеспечивая высокую эффективность процессов синтеза и обработки различных продуктов. Такие жидкости широко применяются в производстве фармацевтических препаратов, пластмасс, косметических и аграрных продуктов, а также в других отраслях химической промышленности.
Жидкости с сильным взаимодействием молекул также находят широкое применение в области научных исследований. Благодаря своим особым свойствам они используются для проведения экспериментов и изучения различных физических, химических и биологических явлений. Эти жидкости помогают ученым лучше понять особенности взаимодействия молекул и разработать новые технологии и материалы.
Кроме того, жидкости с сильным взаимодействием молекул имеют применение в области энергетики. Они могут использоваться в качестве рабочих жидкостей в тепловых электростанциях, при производстве и хранении топлива и других энергетических материалов. Такие жидкости позволяют повысить эффективность процессов конвертации энергии, что делает их ценными в энергетической отрасли.
Интересные перспективы открываются и в области медицины. Жидкости с сильным взаимодействием молекул, благодаря своим уникальным свойствам, могут использоваться в качестве носителей лекарственных веществ. Это позволяет более эффективно доставлять лекарства к нужным местам в организме и повышать их биодоступность.