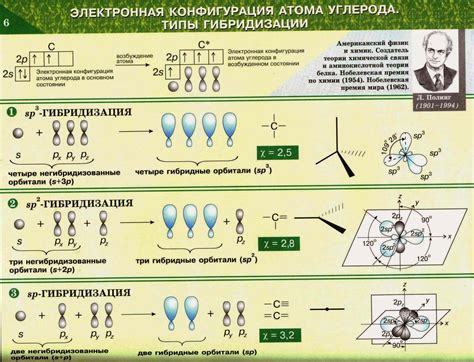
Гибридизация - ключевой концепт в органической химии, который позволяет понять устройство и свойства органических соединений. Важным аспектом изучения гибридизации является определение ее различных видов - s-, sp-, sp2- и sp3-гибридизации. Каждый вид гибридизации обладает своими особенностями и характеристиками, которые определяют поведение и связи атомов углерода.
Первым и наиболее простым видом гибридизации является s-гибридизация. В данном виде гибридизации один s-орбитальный электрон атома углерода сливается с тремя p-орбитальными электронами, образуя четыре sp3-гибридизированные орбитали. Такая гибридизация выглядит как четырехугольная плоская структура, где все связи между атомами углерода являются одиночными.
Второй вид гибридизации - sp-гибридизация - включает слияние одной s-орбитали и одной p-орбитали электронов. Одной s-орбитали образца sp-гибридизации среди двух p-орбиталей. Этот вид гибридизации присутствует в алкенах и алканах и дает им более компактную, линейную структуру. Характерной особенностью sp-гибридизации является наличие одной двойной связи между атомами углерода.
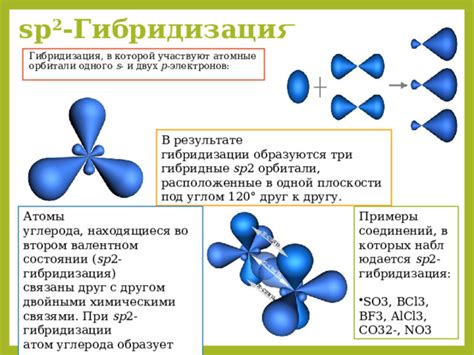
Третий и четвертый виды гибридизации - sp2- и sp3-гибридизации - имеют схожие особенности. В обоих случаях в образе сливаются одна s-орбиталь электронов и две или три p-орбитали соответственно. Разница между ними заключается в количестве атомов углерода, связанных одним атомом углерода. Если углерод соединяется с тремя атомами углерода, то говорят о sp2-гибридизации и результирующей плоской структуре. Если углерод соединяется с четырьмя атомами углерода, то говорят о sp3-гибридизации и результирующей пирамидальной или тетраэдрической структуре. Оба вида гибридизации широко распространены в органических соединениях и играют ключевую роль в их свойствах и реакциях.
Способы определения гибридизации в органических соединениях

Существует несколько способов определения гибридизации атомов:
| Методы определения гибридизации | Описание |
|---|---|
| Метод VSEPR | Этот метод основан на предположении, что атомы молекулы максимально отталкиваются друг от друга, что приводит к определенным геометрическим формам молекул. Гибридизация атомов определяется на основе числа и типа заместителей вокруг центрального атома. |
| Сравнение длин связей | Гибридизация атомов может быть определена путем сравнения длин связей в молекуле. Например, связь sp3 обычно более короткая, чем связь sp2. |
| Изучение молекулярных орбиталей | Метод основан на анализе электронных орбиталей молекулы. Гибридизация определяется на основе форм молекулярных орбиталей и их энергетических уровней. |
| Спектроскопические методы | Спектроскопические методы, такие как ЯМР-спектроскопия и ИК-спектроскопия, позволяют определить гибридизацию атомов в молекуле. |
Выбор метода определения гибридизации зависит от конкретной молекулы и доступных инструментов и методов анализа. Комбинирование различных методов может быть полезным для получения более точных результатов.
Преимущества и недостатки разных методов определения гибридизации
Один из наиболее распространенных методов определения гибридизации - это определение на основе геометрии молекулы. По геометрии молекулы можно судить о гибридизации атомов: например, когда атомы обладают линейной геометрией, можно предположить, что они имеют сп^1 гибридизацию. Однако, этот метод не всегда является точным, так как гибридизация может зависеть от реакционных условий или особенностей структуры молекулы.
Другим методом определения гибридизации является метод гибридизации атомов по количеству связей. Например, если атом образует четыре связи, то можно предположить, что он имеет sp^3 гибридизацию. Этот метод достаточно прост в применении и дает хорошие результаты в большинстве случаев. Однако, он может не давать точного результата, если атом образует нестандартные связи или если есть особенности в строении молекулы.
Также существуют методы определения гибридизации на основе спектроскопии. Например, спектроскопия ЯМР может дать информацию о типе гибридизации атомов, основываясь на химическом сдвиге пиков. Этот метод является достаточно точным и надежным, но требует специального оборудования и экспертизы в области интерпретации спектров.
Каждый метод определения гибридизации имеет свои преимущества и недостатки. Поэтому, для достижения наиболее точных результатов, следует использовать комбинацию нескольких методов и учитывать особенности структуры и свойства молекулы.
Химические свойства гибридизации в органических соединениях
Гибридизация в органических соединениях играет важную роль в их химических свойствах. Она влияет на геометрию молекулы, распределение электронной плотности, а также на образование химических связей.
Первое свойство гибридизации, которое следует рассмотреть, это углы связей в молекуле. Гибридизация определяет геометрию молекулы и, следовательно, углы между связями. Например, молекула метана (CH4), где атом углерода способен образовать четыре одинаковых связи с атомами водорода, имеет геометрию тетраэдра и все углы связей равны 109,5°.
Другое важное химическое свойство, обусловленное гибридизацией, это образование π-связей. Гибридные орбитали, образующие σ-связи, могут также быть использованы для образования π-связей. Примером молекулы с π-связями является этилен (C2H4), где две гибридные орбитали углерода образуют σ-связи с атомами углерода и водорода, а пи-орбитали образуют π-связь между атомами углерода.
Также гибридизация влияет на способность молекулы участвовать в реакциях. Например, гибридизация sp2 позволяет атомам углерода образовывать трехчленные кольца и участвовать в реакциях, таких как циклоприсоединение и электроциклоприсоединение. Гибридизация sp3 обеспечивает насыщенность углеводородных молекул и их устойчивость.
Общая химическая активность органических соединений также зависит от их гибридизации. Гибридизация sp2 делает молекулы более реакционноспособными, так как они имеют плоскую геометрию, что способствует более эффективному взаимодействию. Гибридизация sp3 же делает молекулы менее реакционноспособными, так как они имеют трехмерную геометрию и их атомы углерода хорошо защищены от реагентов.
Таким образом, гибридизация имеет значительное влияние на химические свойства органических соединений. Она определяет не только геометрию молекулы, но и способность соединения участвовать в реакциях и проявлять химическую активность.
Основные типы гибридизации в органических соединениях
Ниже приведена таблица, в которой перечислены основные типы гибридизации и примеры соединений, в которых они встречаются:
| Тип гибридизации | Примеры соединений |
|---|---|
| sp3 | метан (CH4), этан (C2H6), пропан (C3H8) |
| sp2 | этен (C2H4), бензол (C6H6), акриловая кислота (C3H4O2) |
| sp | этилен (C2H4), формальдегид (CH2O), ацетилен (C2H2) |
Каждый тип гибридизации определяет особенности строения молекулы и ее химические свойства. Например, сп3-гибридизация свойственна спиральообразным областям, в то время как сп2- и сп-гибридизация приводят к плоским и линейным структурам соответственно.
Знание основных типов гибридизации позволяет понимать, какую форму и свойства имеют органические соединения, и какие типы химических связей присутствуют в их структуре. Это основа для понимания реакций и свойств соединений, а также для проектирования новых органических веществ с определенными свойствами.
Примеры гибридизации в реальных органических соединениях
В органической химии существует большое количество соединений, в которых можно наблюдать различные виды гибридизации атомов углерода. Рассмотрим несколько примеров таких соединений:
Метан (CH4) - основной пример гибридизации sp3. В метане углерод образует четыре однородные связи с атомами водорода, образуя тетраэдрическую заполненную структуру.
Этен (C2H4) - пример гибридизации sp2. Гибридизованные орбитали углерода образуют три σ-связи с атомами углерода и водорода, а пустая рорбиталь p образует π-связь между атомами углерода.
Этин (C2H2) - пример гибридизации sp. Гибридизованные орбитали углерода образуют две σ-связи с атомами углерода и водорода, а две пустые рорбитали p образуют две π-связи между атомами углерода.
Бензол (C6H6) - пример гибридизации sp2. Углеродные атомы бензола образуют σ-связи с атомами водорода и другими атомами углерода. Каждый углеродный атом также имеет пустую рорбиталь p, которая участвует в образовании π-связей вокруг кольца бензола.
Это только некоторые из примеров гибридизации, которые можно встретить в органических соединениях. Изучение этих примеров позволяет понять, как различные виды гибридизации влияют на структуру и свойства органических молекул.
Влияние гибридизации на структуру и свойства органических соединений
Гибридизация атомных орбиталей оказывает существенное влияние на структуру и свойства органических соединений. Количество и тип гибридизированных орбиталей определяют связи и геометрию молекулы.
В органической химии широко распространены трехцентровая и многицентровая гибридизация. Благодаря этим процессам возникают различные виды химических связей: однородные и гетерогенные, простые и сложные.
Гибридизация sp приводит к образованию плоских молекул, таких как алкены, ацетилен и карбоновые кислоты. Эти соединения обладают плоской треугольной геометрией, что позволяет проявлять свойства плоских систем.
Гибридизация sp2 образует молекулы с плоскими или почти плоскими геометриями, такими как алкены, ароматические соединения и нитрилы. Они обладают хорошей проводимостью электрического тока и высокой цветностью.
Гибридизация sp3 приводит к образованию молекул с тетраэдрической геометрией, таких как алканы и аминокислоты. Такие молекулы обладают высокой стерической гибкостью и инертностью к химическим реакциям.
Гибридизация атомных орбиталей также влияет на энергетическую устойчивость соединений. Например, ароматические соединения, где атомы углерода гибридизованы в sp2, обладают более низкой энергией, чем их насыщенные аналоги.