Белки играют важную роль в организме, выполняя множество функций. Они участвуют в формировании клеток, тканей и органов, а также служат в качестве ферментов, гормонов и антикорпусов. Чтобы белки выполняли свои функции, необходима правильная структура, которая формируется за счет взаимодействия аминокислотных остатков.
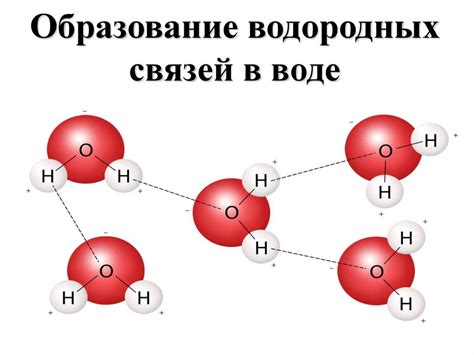
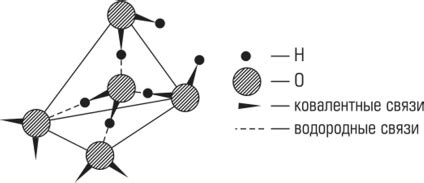
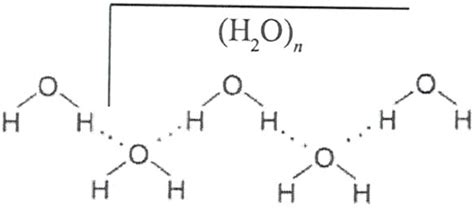
Водородные связи - одна из основных форм взаимодействия между аминокислотными остатками в белках. Водородный связи возникают между атомами водорода и атомами кислорода, азота или серы. Они образуются благодаря разнице в электроотрицательности атомов и возможности водорода образовывать слабые привлекательные силы с другими атомами.
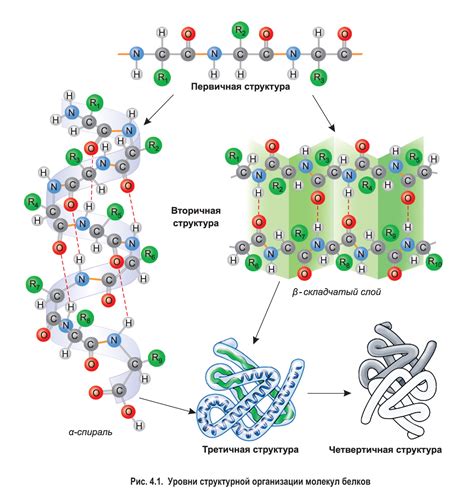
Уникальность водородных связей в белках заключается в их способности участвовать в формировании различных уровней структуры. Они способны связывать аминокислотные остатки в пространственно организованные структуры, такие как спиральные α-геликсы и сложно складывающиеся β-складки. Эти пространственные структуры определяют функции белка и его способность связываться с другими молекулами.
Влияние аминокислотного состава на образование водородных связей
Аминокислоты, содержащие положительно заряженные аминогруппы, такие как лизин и аргинин, могут образовывать водородные связи с отрицательно заряженными карбоксильными группами других аминокислотных остатков. Эти водородные связи могут способствовать стабилизации структуры белка, укрепляя взаимодействия между аминокислотами.
Серин и треонин, содержащие гидроксильные группы, также могут образовывать водородные связи с другими аминокислотами, в зависимости от их расположения в пространстве. Эти водородные связи могут быть важны для стабилизации элементов вторичной структуры, таких как спираль α и лист β, которые являются ключевыми структурными мотивами в пространственной организации белка.
Однако, не все аминокислотные остатки имеют группы, способные образовывать водородные связи. Например, глицин не имеет боковой цепи и, следовательно, не способен образовывать водородные связи с другими аминокислотами. Это может влиять на его способность взаимодействовать с другими участниками белковой структуры и, возможно, на его роль в стабилизации конкретных структурных элементов.
Таким образом, аминокислотный состав белка играет важную роль в формировании водородных связей и стабилизации его структуры. Изучение этих взаимодействий может помочь в понимании связи между аминокислотным составом и биологическими функциями белков.
Роль водородных связей в структуре белков
Водородные связи между аминокислотными остатками играют ключевую роль в формировании пространственной структуры белка. Первичная структура белка, которая представляет собой последовательность аминокислот, определяет взаимодействие водородных связей в трехмерной структуре. Отличительной особенностью водородных связей является их направленность и способность образовывать водородные мосты сразу с несколькими соседними атомами. Это особенно важно при формировании вторичной структуры белка, такой как α-спираль и β-складка.
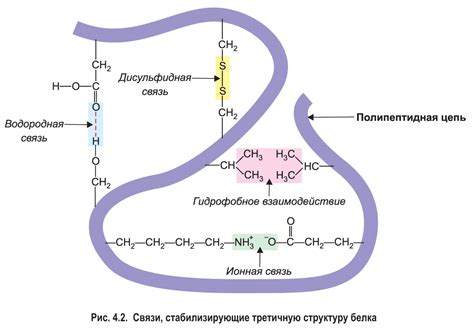
Кроме того, водородные связи могут стабилизировать третичную и кватернерную структуру белка. Они обеспечивают взаимодействие различных цепей аминокислот и способствуют формированию пространственных узлов и складок. Водородные связи также могут играть роль в распознавании и связывании других молекул, таких как ферменты и лиганды.
В целом, водородные связи по силе и особенностям своего образования являются важной составляющей структуры белков. Они обеспечивают стабильность и функциональность белков, повышают их специфичность и участвуют во многих биологических процессах.
Факторы, влияющие на образование водородных связей

Водородные связи в белках играют важную роль в их структуре и функции. Формирование этих связей происходит между аминокислотными остатками и зависит от нескольких факторов.
Первым фактором является разность электроотрицательности атомов, участвующих в образовании связи. Чем больше разница в электроотрицательности, тем сильнее взаимодействие и стабильнее образующаяся связь. Например, атом кислорода с более высокой электроотрицательностью может образовывать более сильные водородные связи с атомами водорода или азота.
Вторым фактором является расстояние между атомами. Для формирования водородной связи, расстояние между донором (атом водорода) и акцептором (атом кислорода, азота или серы) должно быть оптимальным. Слишком близкое расположение может привести к отталкиванию, а слишком большое – к ослаблению взаимодействия и разрыву связи.
Третьим фактором является геометрия молекулы. Оптимальное формирование водородной связи требует правильной ориентации атомов. Например, атом водорода должен находиться в определенном расстоянии и угловом положении относительно акцептора, чтобы эффективно образовать связь.
Кроме того, окружающая среда также может влиять на образование водородных связей. Факторы, такие как pH, температура и наличие других молекул, могут изменять силу и стабильность водородных связей в белках.
В целом, понимание факторов, влияющих на образование водородных связей, помогает в изучении структуры и функции белков, а также в разработке методов, направленных на улучшение их стабильности и активности.
Импортантность водородных связей в биологических процессах
Водородные связи обеспечивают стабильность и устойчивость структуры белка. Они играют важную роль в формировании вторичной структуры белка, такой как α-спираль и β-складки. Водородные связи также способствуют формированию третичной и кватернарной структуры белков, взаимодействуя между полипептидными цепями и поддерживая определенное пространственное расположение функциональных групп.
Водородные связи также играют важную роль в распознавании и взаимодействии белков с другими молекулами. Они обеспечивают точность и специфичность молекулярного распознавания, позволяя взаимодействовать только с определенными лигандами или рецепторами. Водородные связи участвуют в молекулярном распознавании в клеточных сигнальных путях, белковых комплексах и многочисленных других биологических процессах.
Благодаря своей слабой силе, водородные связи позволяют белкам и другим биологическим молекулам изменять свою структуру и функцию в ответ на изменяющиеся условия. Это обеспечивает гибкость и пластичность в молекулярных механизмах жизни.
Водородные связи и стабильность белковой структуры
Водородные связи формируются благодаря электростатическому притяжению положительно заряженных водородных атомов и отрицательно заряженных атомов кислорода или азота. Аминокислоты, содержащие эти атомы, могут образовывать одну или несколько водородных связей с другими аминокислотами или молекулами в процессе сворачивания белка.
Водородные связи способны укреплять белковую структуру, делая ее более устойчивой к воздействию внешних факторов, таких как температура, pH или наличие растворителей. Они могут препятствовать отклонениям от идеальной трехмерной конформации белка, а также участвовать в формировании вторичных структур, таких как α-спирали и β-складки.
Важно отметить, что водородные связи не являются единственным механизмом, обеспечивающим стабильность белковой структуры. Другие факторы, такие как гидрофобные взаимодействия, ионные связи и сульфидные мостики, также играют важную роль в формировании и удержании трехмерной конформации белков.
Таким образом, водородные связи являются неотъемлемой частью сложной паззлы стабильности белковой структуры. Понимание их роли и влияния на белковую структуру позволяет лучше понять физические и химические основы молекулярного взаимодействия в организмах и открывает новые перспективы в области разработки и проектирования белковых структур.
Взаимодействие водородных связей с другими типами связей
Водородные связи играют важную роль в структуре и функционировании белков. Они обеспечивают устойчивость пространственной конформации белка и сильно влияют на его свойства и функции.
Наиболее распространенным типом связей в белках являются водородные связи между аминокислотными остатками. Эти связи образуются между атомами водорода одной аминокислоты и атомами кислорода или азота другой аминокислоты. Водородные связи обладают высокой прочностью и позволяют удерживать атомы в заданном положении в пространстве.
Однако водородные связи также взаимодействуют с другими типами связей. Например, они могут усиливать гидрофобное взаимодействие между гидрофобными остатками аминокислот. Водородные связи также могут влиять на образование солевой связи, которая образуется между атомами кислорода или азота аминокислоты с заряженными группами аминокислот.
В молекульных комплексах, взаимодействие водородных связей с другими типами связей может способствовать образованию стабильной пространственной структуры и устойчивости макромолекулы. Кроме того, взаимодействие водородных связей может играть роль в молекулярном распознавании и связывании, что является основой для многих биологических процессов.
Таким образом, взаимодействие водородных связей с другими типами связей в белках играет важную роль в формировании и функционировании белковой структуры. Понимание этих взаимодействий помогает углубить знания о белках и их свойствах, что может быть полезно для разработки новых лекарственных препаратов и биотехнологических продуктов.
Практическое применение в человеческом организме
Водородные связи между аминокислотными остатками играют ключевую роль во многих процессах, которые происходят в организме человека.
1. Стабилизация пространственной структуры белка. Водородные связи способны связывать различные части белка между собой, образуя стабильные трехмерные структуры. Это важно для сохранения функциональности белка и его взаимодействия с другими молекулами в организме.
2. Распознавание и связывание белков. Водородные связи могут играть ключевую роль в молекулярном распознавании и связывании, позволяя белкам взаимодействовать с другими молекулами, например, ферментами и рецепторами. Это важно для множества биологических процессов, включая сигнальные пути, транспорт и метаболизм.
3. Формирование плечевой стрелки антитела. Водородные связи способны образовывать плечевую стрелку антитела, которая определяет его способность связываться с антигенами. Это важно для защиты организма от инфекций и других вредных воздействий.
4. Регуляция активности белков. Водородные связи могут влиять на активность белков, способствуя или подавляя их функциональность. Это позволяет организму регулировать биологические процессы и подстраивать их под текущие условия.
5. Формирование ферментативных карманов. Водородные связи между аминокислотными остатками способны создавать активные участки белков - ферментативные карманы, в которых происходят химические реакции. Это важно для катализа различных биохимических процессов в организме человека.
Таким образом, понимание влияния водородных связей на структуру и функцию белков позволяет применять этот знак в различных областях медицины и биотехнологии, включая разработку новых лекарственных препаратов, диагностических методов и технологий для терапии различных заболеваний.