В нивоэнергетической модели атома, электроны располагаются на различных энергетических уровнях, называемых подуровнями. Каждый подуровень может вместить определенное количество электронов, которое определяется формулой 2n^2, где n - номер главного уровня. Это означает, что на каждом подуровне может быть разное количество электронов.
На первом энергетическом уровне (n=1) есть всего один подуровень, на котором может располагаться максимум 2 электрона - s-подуровень. На втором уровне (n=2) уже два подуровня: s-подуровень и p-подуровень. S-подуровень может вместить до 2 электронов, а р-подуровень может содержать до 6 электронов. На третьем уровне (n=3) также имеется три подуровня: s-подуровень, р-подуровень и d-подуровень. S-подуровень может содержать до 2 электронов, р-подуровень - до 6 электронов, а d-подуровень - до 10 электронов.
Таким образом, число электронов на подуровнях нивоэнергетической модели зависит от номера главного энергетического уровня и от типа подуровня. Каждый подуровень имеет определенную емкость, которую следует учитывать при построении электронной конфигурации атома.
Сколько электронов на подуровнях?
Первая модель атома, которая была предложена Нильсом Бором, основана на нивоэнергетической модели. В этой модели электроны распределены по электронным оболочкам и подуровням.
Энергетический уровень атома называется электронной оболочкой. Каждая оболочка имеет свой номер, который соответствует главному квантовому числу.
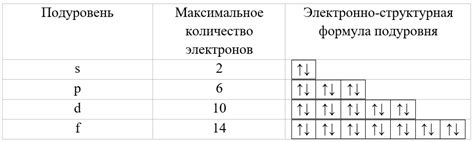
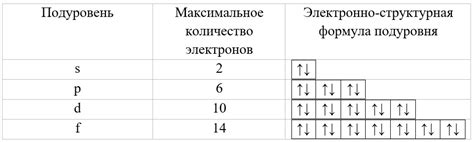
Каждая электронная оболочка состоит из подуровней, которые обозначаются буквами s, p, d, f. Каждый подуровень может содержать определенное количество электронов:
- Подуровень s может содержать максимум 2 электрона.
- Подуровень p может содержать максимум 6 электронов.
- Подуровень d может содержать максимум 10 электронов.
- Подуровень f может содержать максимум 14 электронов.
Как правило, электроны заполняют подуровни в порядке возрастания их энергии. Таким образом, на первом энергетическом уровне может находиться только одна оболочка s с двумя электронами, на втором уровне может находиться две оболочки s и p с максимально возможным количеством электронов, и так далее.
Таким образом, нивоэнергетическая модель позволяет определить, сколько электронов может находиться на каждом подуровне атома. Это понимание является важным для понимания строения атомов и их химических свойств.
Распределение электронов в нивоэнергетической модели
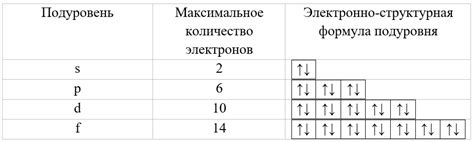
Каждый электрон в атоме может находиться на одном из возможных подуровней, которых всего четыре: s, p, d и f. Каждый подуровень имеет фиксированный энергетический уровень. Подуровни обладают различным количеством мест для размещения электронов.
На подуровне s может находиться до 2 электронов, на подуровне p - до 6 электронов, на подуровне d - до 10 электронов и на подуровне f - до 14 электронов. Эти числа определены правилом Паули, согласно которому каждый электрон должен занимать отдельное место на подуровне, как минимум по одному в направлении "вверх" и "вниз" по спиновому состоянию.
Таким образом, в нивоэнергетической модели представление электронной структуры атома каждый подуровень может быть заполнен определенным числом электронов: s - 2, p - 6, d - 10, f - 14.
Как формируются электронные оболочки?

Электронные оболочки формируются в результате распределения электронов в атоме по различным энергетическим уровням и подуровням. В основе этого процесса лежит нивоэнергетическая модель, которая описывает энергетические уровни электронов в атоме.
Атом состоит из ядра и электронных оболочек. Ядро содержит протоны и нейтроны, а электронные оболочки располагаются вокруг ядра и содержат электроны. Каждая электронная оболочка представляет собой энергетический уровень, на котором могут находиться электроны.
Электроны распределяются по энергетическим уровням в соответствии с нивоэнергетической моделью. Первая электронная оболочка (K-оболочка) может содержать максимум 2 электрона. Вторая электронная оболочка (L-оболочка) может содержать максимум 8 электронов. Третья электронная оболочка (M-оболочка) может содержать максимум 18 электронов, и так далее.
Каждая электронная оболочка состоит из подуровней, которые имеют различные формы и названия. На каждом подуровне может находиться определенное число электронов. Подуровни обозначаются буквами s, p, d, f. Например, первая электронная оболочка имеет только подуровень s, вторая оболочка имеет подуровни s и p, третья оболочка имеет подуровни s, p, d, и так далее.
Распределение электронов по энергетическим уровням и подуровням происходит в соответствии с принципом заполнения. Этот принцип устанавливает, что электроны заполняют доступные подуровни с наименьшей энергией сначала. Таким образом, каждый подуровень заполняется последовательно и электронная конфигурация атома определяется количеством электронов в каждой электронной оболочке и подуровне.
Формирование электронных оболочек является важной особенностью строения атомов и определяет их химические свойства. Распределение электронов в электронных оболочках атома имеет большое значение для понимания молекулярных связей и реакций, происходящих в химических системах.
Определение количества электронов на подуровнях
Для определения количества электронов на подуровнях в нивоэнергетической модели, необходимо знать различия между орбиталями и подуровнями.
Орбиталь - это область пространства, где с высокой вероятностью можно найти электрон. Орбитали обозначаются буквами s, p, d, f и так далее.
Подуровень - это результат комбинации орбиталей. Он обозначается буквой с индексом, который указывает на главный квантовый числовой уровень и моментного квантового числового уровня.
В таблице представлено значение главного квантового числового уровня (n), моментного квантового числового уровня (l), названия подуровней и количество электронов на каждом подуровне.
| Номер подуровня | Название подуровня | Количество электронов |
|---|---|---|
| 1s | s | 2 |
| 2s | s | 2 |
| 2p | p | 6 |
| 3s | s | 2 |
| 3p | p | 6 |
| 4s | s | 2 |
| 3d | d | 10 |
| 4p | p | 6 |
| 5s | s | 2 |
| 4d | d | 10 |
| 5p | p | 6 |
| 6s | s | 2 |
| 4f | f | 14 |
| 5d | d | 10 |
| 6p | p | 6 |
| 7s | s | 2 |
| 5f | f | 14 |
| 6d | d | 10 |
| 7p | p | 6 |
Таким образом, для определения количества электронов на подуровнях необходимо знать номер главного квантового числового уровня (n) и номер моментного квантового числового уровня (l), а затем использовать данную таблицу.
Взаимное расположение и заполнение подуровней
В нивоэнергетической модели атома, подуровни обозначаются буквами s, p, d и f. Каждый подуровень может вмещать разное количество электронов в зависимости от своего типа.
Самый низкий по энергии подуровень - s. Он может вмещать максимум 2 электрона. Следующий по энергии подуровень - p, может вместить до 6 электронов. Третий по энергии - d, имеет возможность вместить до 10 электронов. Наконец, самый высокий по энергии - f, способен вместить до 14 электронов.
Когда атом заполняет свои электроны, они заполняются с низкой энергии к высокой. Сначала заполняются все доступные подуровни с более низкой энергией, а затем переходят к подуровням с более высокой энергией.
Это означает, что уровень s будет заполнен первым, за ним - p, затем - d и, наконец, f.
Всего на каждом энергетическом уровне может быть максимально заполнено:
- 1 подуровень s с 2 электронами
- 3 подуровня p с 6 электронами (каждый подуровень может вместить до 2 электронов)
- 5 подуровней d с 10 электронами (каждый подуровень может вместить до 2 электронов)
- 7 подуровней f с 14 электронами (каждый подуровень может вместить до 2 электронов)
Таким образом, зная взаимное расположение и заполнение подуровней, можно определить максимальное количество электронов, которое может содержать тот или иной энергетический уровень.
Расчет количества электронов на подуровнях
Для того чтобы определить максимальное количество электронов на каждом подуровне, необходимо знать его тип и орбитальное состояние.
На s-подуровнях может находиться максимум 2 электрона. Учитывая, что в нивоэнергетической модели существует только одно s-подуровней, количество электронов на нем будет равно 2.
На p-подуровнях максимальное количество электронов равно 6. Поскольку в нивоэнергетической модели существует три p-подуровня, на каждом из них может находиться по 2 электрона.
У d-подуровней максимальное количество электронов составляет 10. В нивоэнергетической модели существует пять d-подуровней, на каждом из которых может находиться 2 электрона.
На f-подуровнях максимальное количество электронов составляет 14. В нивоэнергетической модели существует семь f-подуровней, на каждом из которых может находиться 2 электрона.
Таким образом, количество электронов на подуровнях нивоэнергетической модели определяется типом подуровня и составляет: 2 для s-подуровней, 6 для p-подуровней, 10 для d-подуровней и 14 для f-подуровней.