Количество вещества эквивалента - один из фундаментальных понятий химии, которое позволяет осуществлять количественные расчеты на основе химических реакций. Это важное понятие, которое позволяет определить количество частиц, таких как атомов, молекул или ионов, участвующих в химической реакции.
В химии количество вещества эквивалента измеряется в единицах - молях. Моль - это количественная единица, которая определяет количество вещества, содержащееся в системе, состоящей из такого же числа элементарных единиц, каких содержится в 12 граммах углерода-12. Таким образом, один моль вещества эквивалента содержит примерно 6,02 х 10 в 23 структурных единиц.
Количество вещества эквивалента часто используется для определения отношения между различными реагентами и продуктами химической реакции. Это позволяет химикам оптимизировать реакцию, контролировать потери вещества и обеспечивать успех соответствующих промышленных процессов. Также, понимание понятия количества вещества эквивалента позволяет проводить сравнительный анализ химических реакций и находить эквивалентные соотношения между различными реагентами.
Определение и основные понятия
Количество вещества эквивалента (n) определяется в зависимости от вещества, с которым взаимодействует данное вещество. Для этого используется так называемый коэффициент экивалента (к), который представляет собой число частичек данного вещества, участвующих в реакции.
Чтобы найти количество вещества эквивалента, нужно умножить количество вещества данного вещества на коэффициент эквивалента:
n = N * k
Где n - количество вещества эквивалента, N - количество вещества данного вещества, k - коэффициент эквивалента.
Количество вещества эквивалента может быть выражено в разных единицах, таких как мол, граммы, миллиграммы и т.д. Важно учитывать единицы измерения при проведении химических расчетов.
Знание о количестве вещества эквивалента помогает определить соотношение между различными веществами в химической реакции, а также предсказать результаты реакции и провести качественный и количественный анализ условий, при которых она происходит.
Формула расчета количества вещества

Количество вещества можно рассчитать с использованием формулы:
n = m / M
где:
- n - количество вещества в молях (mol);
- m - масса вещества в граммах (g);
- M - молярная масса вещества в г/моль (g/mol).
Таким образом, количество вещества можно получить, разделив массу вещества на его молярную массу. Эта формула позволяет определить количество вещества в субстанции и является очень важной в химических расчетах.
Пример:
Допустим, у нас есть 100 граммов воды (H2O). Молярная масса воды составляет около 18 г/моль. Чтобы рассчитать количество вещества воды, мы используем формулу:
n = 100 г / 18 г/моль ≈ 5.56 моль
Таким образом, в 100 граммах воды содержится примерно 5.56 моль воды.
Значение количества вещества в химических реакциях

В химических реакциях вещества реагируют в определенных пропорциях. Количество вещества эквивалента позволяет установить соответствующие связи между этими пропорциями. Обычно в реакциях используется моль. Одна моль вещества содержит на Авогадро число элементарных частиц, что составляет примерно 6,02 x 10^23 единиц.
Количество вещества эквивалента позволяет рассчитать стехиометрические соотношения в реакции. Стехиометрия в химии изучает количественные соотношения между реагентами и продуктами химических реакций. С помощью количества вещества эквивалента можно определить, сколько вещества нужно для проведения реакции или сколько получится продуктов.
Чтобы рассчитать количество вещества эквивалента, необходимо знать молярную массу вещества. Молярная масса выражается в граммах и определяется как масса одной моли вещества. Зная молярную массу и массу вещества, можно вычислить количество вещества эквивалента по формуле: количество вещества = масса / молярная масса.
| Единица измерения | Обозначение | Значение |
|---|---|---|
| Моль | моль | 6,02 x 1023 единиц |
| Молярная масса | г/моль | масса одной моли вещества |
Значение количества вещества эквивалента в химических реакциях позволяет проводить точные расчеты и оптимизировать процессы синтеза или анализа веществ. Оно играет важную роль в физической и аналитической химии, а также во всех отраслях науки и промышленности, где используется химия.
Количество вещества эквивалента и моль
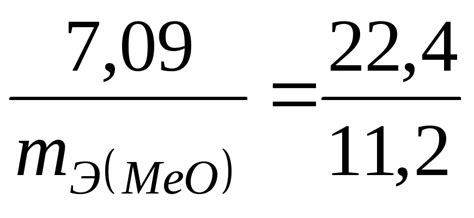
Количество вещества эквивалента в химии относится к количеству вещества, которое реагирует или образуется в химической реакции. Это важная физическая величина, которая помогает определить количество реагентов и продуктов в реакции.
Количество вещества эквивалента обычно измеряется в одноименных единицах - эквивалентах. Эквивалент - это количество вещества, которое содержит столько же реакционных частиц (атомы, ионы, молекулы), сколько содержится в одном моле вещества.
Моль - это международная единица измерения количества вещества, обозначаемая символом "моль" (мол). В одном моле содержится столько же реакционных частиц, сколько атомов вещества содержится в 12 граммах углерода-12. Это число, называемое числом Авогадро, равно приблизительно 6.02 x 10^23.
Когда вещество разлагается или образуется в реакции, количество вещества эквивалента зависит от молекулярной массы вещества и коэффициентов реакции. Например, если молекулярная масса воды (H2O) равна 18 г/моль, то 1 моль воды будет содержать 18 грамм, и это будет эквивалентной массой воды. Если в реакции участвует 2 моли H2O, то количество вещества эквивалента будет 36 грамм.
Использование эквивалентов и моль в химии позволяет точно определить количественные пропорции и проводить расчеты в реакциях. Это важное понятие помогает химикам понять, как вещества взаимодействуют друг с другом и какие количества реагентов и продуктов присутствуют в химической системе.
Примеры использования количества вещества эквивалента

- Определение массы продукта реакции: при известном количестве вещества эквивалента реагента и известном коэффициенте превращения, можно рассчитать массу продукта реакции. Например, если известно, что 1 моль вещества А реагирует с 2 молями вещества В, то при известном количестве вещества В можно рассчитать количество вещества А, участвующего в реакции, а затем и массу продукта.
- Определение эквивалентной массы вещества: эквивалентная масса вещества равна массе этого вещества, содержащейся в 1 моле эквивалентов. Например, эквивалентная масса кислоты может быть определена с помощью количества вещества эквивалента щелочи, необходимого для нейтрализации данной кислоты.
- Расчет количества вещества по объему раствора: зная концентрацию раствора и его объем, можно рассчитать количество вещества, содержащегося в этом растворе, используя количества эквивалентов вещества.
- Определение степени окисления вещества: количества вещества эквивалента могут быть использованы для определения степени окисления вещества в химической реакции. Зная количество эквивалентов вещества, можно определить, сколько электронов было перенесено в реакции.
Таким образом, количество вещества эквивалента имеет важное значение при решении различных химических задач и является неотъемлемой частью химических расчетов.