Атом, как основная строительная единица вещества, постоянно находится в движении, так как электроны на его электронных уровнях обладают энергией. Количество электронных уровней в атоме зависит от его электронной конфигурации и числа электронов. Понимание этой важной характеристики атома позволяет более глубоко изучать его свойства и взаимодействия.
Электронные уровни представляют собой энергетические уровни, на которых находятся электроны в атоме. Они различаются по своей энергии и степени близости к ядру атома. Первый электронный уровень, находящийся самым близко к ядру, обладает наименьшей энергией, а последующие уровни имеют все большую энергию.
Число электронных уровней в атоме определяется структурой его электронных оболочек. Каждая электронная оболочка может содержать определенное количество электронов. Наибольшее количество электронов может находиться на первом электронном уровне, затем на втором уровне и так далее. Этот закон распределения электронов по электронным уровням называется правилом Хунда.
Число электронных уровней в атоме
Число электронных уровней в атоме зависит от его электронной конфигурации. Электронная конфигурация атома указывает, как распределены электроны по энергетическим уровням.
Наиболее близкий к ядру уровень называется первым электронным уровнем или основным уровнем. Для атома, имеющего N электронов, число электронных уровней равно максимальному числу электронов на одном уровне по таблице Менделеева.
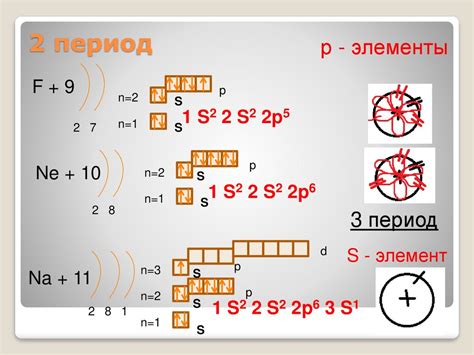
Например, у атома натрия есть 11 электронов. По таблице Менделеева мы видим, что на первом уровне может быть не больше 2 электронов, на втором - не больше 8. Таким образом, у атома натрия будет 2 электрона на первом уровне и 8 на втором. И, следовательно, всего два электронных уровня.
Число электронных уровней также может быть определено по периодам в таблице Менделеева. Каждый период соответствует новому электронному уровню и, следовательно, число уровней равно номеру периода.
В общем случае, число электронных уровней в атоме равно числу заполненных энергетических уровней плюс один незаполненный уровень.
Итак, число электронных уровней в атоме зависит от электронной конфигурации атома и может быть определено как число заполненных уровней плюс один незаполненный уровень.
Основные факты

Атом состоит из ядра, которое содержит протоны и нейтроны, и облака электронов, которые движутся вокруг ядра на электронных орбиталях.
Число электронных уровней в атоме определяется номером периода в таблице Менделеева. На каждом электронном уровне может находиться определенное количество электронов.
Первый электронный уровень может вместить только 2 электрона, второй - 8 электронов, третий - 18 электронов, четвертый - 32 электрона, пятый - 50 электронов, шестой - 72 электрона и так далее.
Электроны находятся на электронных уровнях, которые обозначаются буквами s, p, d, f. Каждый электронный уровень содержит одну или несколько субуровней.
Суммарное число электронов на каждом электронном уровне не может превышать общее число электронов в атоме.
Свойства
Каждый электронный уровень может вмещать ограниченное количество электронов. На первом электронном уровне может находиться только 2 электрона, на втором - 8, на третьем - 18, и так далее. Исключение составляют внешние электронные уровни, на которых может находиться до 32 электронов.
Энергия электронов на электронных уровнях также определяет химические свойства атома. Чем ближе электрон к ядру атома, тем выше его энергия и меньше радиус орбиты, на которой он находится. Электроны на наиболее близких к ядру электронных уровнях называются внутренними электронами, а электроны на внешних уровнях - внешними электронами. Полярность и реакционная способность атома могут быть связаны с количеством и энергией его внешних электронов.
Переход электрона с одного электронного уровня на другой может сопровождаться поглощением или испусканием фотонов света определенной энергии. Это явление называется электронной переход или атомным спектром и может использоваться для идентификации веществ и изучения их структуры.
Влияние

Количество электронных уровней в атоме играет важную роль в его химических и физических свойствах. Оно определяет структуру атома и его поведение при взаимодействии с другими атомами и молекулами.
Число электронных уровней влияет на энергетическую структуру атома. Каждый электронный уровень обладает определенной энергией, которая определяется положением электрона относительно ядра атома. Чем больше уровней имеет атом, тем больше энергетических состояний он может принимать.
Электронные уровни также определяют химическую активность атома. Наибольшую активность проявляют атомы, у которых электронные уровни не заполнены полностью. Это связано с тем, что такие атомы стремятся достичь более стабильного состояния, заполнив все свои электронные уровни. Поэтому атомы с неполностью заполненными уровнями склоны к образованию химических связей и участию в химических реакциях.
Важным свойством атомов с разным количеством электронных уровней является их размер. У атомов с большим числом уровней размеры обычно больше, так как их электроны размещаются на более удаленных от ядра орбиталях. Это связано с увеличением радиуса атома и возрастающим размером электронных облаков. Кроме того, у атомов с более полностью заполненными электронными уровнями радиус обычно меньше, так как их электроны распределены более плотно вокруг ядра.
Влияние количества электронных уровней на свойства атомов способствует их классификации и систематизации. Атомы с одинаковым числом электронных уровней обладают схожими свойствами и могут быть объединены в группы и периоды в таблице Менделеева. Это позволяет легче изучать и предсказывать реактивность и химическую активность различных элементов.
Значение
Число электронных уровней в атоме имеет фундаментальное значение в понимании структуры и свойств атомов. Оно определяет возможные энергетические состояния, которые могут быть заняты электронами.
Каждый электронный уровень является энергетическим состоянием, на котором может находиться один или два электрона, одинакового спина. Они располагаются на различных расстояниях от ядра и обладают определенной энергией.
Наиболее близкие электронные уровни к ядру имеют меньшую энергию, а находящиеся дальше - большую. Это означает, что энергия электрона на более близком уровне меньше, чем на более дальнем.
Количество электронных уровней в атоме зависит от его электронной конфигурации и количества электронов. Например, у атома водорода есть только один электронный уровень, так как в нем содержится только один электрон. Атомы других элементов имеют более сложную электронную структуру и соответственно большее количество электронных уровней.
Значение числа электронных уровней в атоме также связано с химическими свойствами элемента. Электроны на более высоких энергетических уровнях могут участвовать в химических реакциях, образуя связи с другими атомами. Изменение количества электронных уровней может привести к изменению химических свойств элемента.
Таким образом, число электронных уровней играет важную роль в объяснении многих физических и химических свойств атомов и элементов.



