Электрохимический ряд напряжений металлов - это таблица, которая демонстрирует возможность окисления или восстановления металлов в растворах электролитов. Этот ряд позволяет предсказать, какой металл будет действовать как анод (окисляться) или как катод (восстанавливаться) в гальванических элементах и электролизе.
Значение электрохимического ряда напряжений металлов определяется их способностью отдавать или принимать электроны. Металлы, имеющие более высокое значение электрохимического ряда, имеют большую способность отдавать электроны и окисляться. Наоборот, металлы с более низким значением электрохимического ряда имеют большую способность принимать электроны и восстанавливаться.
Электрохимический ряд напряжений металлов широко используется в химии и электрохимии. Он позволяет предсказать, какие реакции между металлами и растворами электролитов будут протекать самопроизвольно, а также определить направление потока электронов в гальванической ячейке. Знание электрохимического ряда также позволяет определить электродный потенциал металлов, что имеет важное практическое значение в процессах электрохимии и при создании различных электронных устройств и батарей.
Важность электрохимического ряда
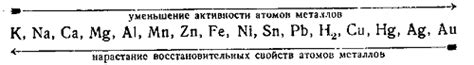
Электрохимический ряд позволяет определить относительные положения различных веществ по их электрохимической активности. Металлы, находящиеся выше в ряду, имеют большую способность отдавать электроны и обладают более высокими окислительными свойствами. Металлы, находящиеся ниже, имеют меньшую способность отдавать электроны и проявляют большую силу восстановителя.
Электрохимический ряд имеет широкое применение в различных областях:
- В химии электрохимический ряд используется для определения степени окисления и восстановления веществ в химических реакциях, предсказания возможности и направления электрохимических реакций.
- В гальванических элементах электрохимический ряд помогает выбирать и сочетать металлы для создания электродов с желаемыми электрохимическими свойствами.
- В области защиты от коррозии электрохимический ряд помогает определить, какие металлы обладают более высокой способностью к коррозии, и как можно использовать металлы с более низкой активностью в качестве анодов для защиты металлов с более высокой активностью от коррозии.
Таким образом, электрохимический ряд является неотъемлемым инструментом в изучении и понимании различных электрохимических процессов и нашел широкое применение в различных отраслях науки и промышленности.
Значение для определения активности металлов

Электрохимический ряд напряжений металлов представлен в виде таблицы, где металлы расположены в порядке увеличения их активности. Положительные значения напряжений указывают на то, что металл является активным и может вступать в реакции окисления, а отрицательные значения указывают на то, что металл является менее активным и может вступать в реакции восстановления.
Зная активность металла, можно предсказать его поведение в химических реакциях. Например, металлы с более высокой активностью будут обладать большей способностью к коррозии, так как они имеют большую тенденцию к окислению. Электрохимический ряд также позволяет определить, какие металлы будут образовывать катоды или аноды при гальванической коррозии.
Электрохимический ряд напряжений металлов также широко используется в электрохимии, где активные металлы используются в качестве электродов для проведения электролиза и других электрохимических процессов. Благодаря электрохимическому ряду можно предсказать направление и результат электрохимических реакций.
| Металл | Напряжение (В) |
|---|---|
| Литий | -3,04 |
| Калий | -2,92 |
| Кальций | -2,87 |
| Натрий | -2,71 |
| Магний | -2,37 |
| Алюминий | -1,66 |
| Цинк | -0,76 |
| Железо | -0,44 |
| Никель | -0,25 |
| Водород | 0 |
| Серебро | +0,80 |
| Золото | +1,50 |
| Платина | +1,99 |
В таблице приведены значения некоторых металлов из электрохимического ряда напряжений, которые позволяют оценить их активность. Более активные металлы находятся в верхней части таблицы с более отрицательными значениями напряжений, а менее активные металлы - ближе к нулю или имеют положительные значения.
Применение в электрохимии

В электрохимии электроды состоят из различных металлов или полуметаллов, которые вступают в реакцию с раствором электролита. Значение электрохимического ряда напряжений металлов позволяет определить, какой металл в ряду будет окислителем, а какой восстановителем.
Электрохимический ряд напряжений металлов определяет порядок их способности вступать в реакцию окисления или восстановления. Металлы, имеющие более положительное значение в ряду, будут иметь большую склонность к окислению, а металлы с более отрицательным значением будут склонны к восстановлению.
Электрохимический ряд напряжений металлов находит широкое применение в различных областях, включая электрохимическое снижение металлов из растворов, электрохимическое окрашивание и покрытие поверхностей, электролиз гальванических элементов и т.д.
Электрохимический ряд напряжений металлов играет важную роль в создании электрохимических систем и определении их эффективности. Правильное использование электрохимического ряда напряжений металлов в электрохимии позволяет контролировать и управлять электрохимическими процессами с высокой точностью.