Диссоциация веществ – процесс, в результате которого они распадаются на более простые компоненты. Однако не все вещества диссоциируются одинаково. Некоторые соединения, такие как соли и основания, демонстрируют особую склонность к диссоциации, превращаясь в ионы при контакте с водой.
Соли – это ионные соединения, состоящие из положительно и отрицательно заряженных ионов. Примерами солей являются хлорид натрия (NaCl), сульфат магния (MgSO4) и нитрат калия (KNO3). При контакте с водой соль диссоциирует, то есть ее молекулы распадаются на ионы.
Основания – это вещества, способные отдавать гидроксидные ионы (OH-) при контакте с водой. Они также обладают способностью к диссоциации. Примерами оснований являются гидроксид натрия (NaOH), гидроксид калия (KOH) и гидроксид аммония (NH4OH). После контакта с водой они разлагаются на ионы гидроксида и соответствующие катионы.
Что такое диссоциация?

Диссоциация является важной химической реакцией, поскольку она позволяет осуществлять множество процессов в органической и неорганической химии. В результате диссоциации образуются ионы положительного и отрицательного заряда, которые могут взаимодействовать с другими веществами и участвовать в различных химических реакциях.
Диссоциация солей особенно важна, так как соли в растворе могут существовать в виде ионов, что облегчает их взаимодействие с другими реагентами и организмами. Диссоциация оснований также играет важную роль в реакциях, связанных с протонами и pH-уровнем раствора.
Диссоциация может проходить полностью или частично, в зависимости от химического соединения и условий реакции. Коэффициент диссоциации показывает, в какой степени соединение расщепляется на ионы. Высокий коэффициент диссоциации указывает на полную диссоциацию, а низкий - на частичную.
Изучение диссоциации солей и оснований позволяет понять и прогнозировать их реактивность, влияние на окружающую среду, а также использовать их в различных химических процессах и технологиях.
Определение и процесс диссоциации в химии
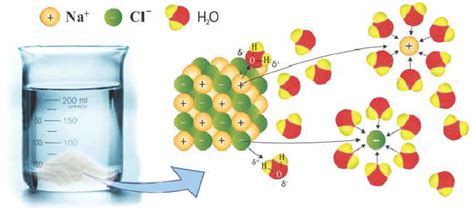
Процесс диссоциации осуществляется под воздействием воды или других растворителей. В результате этого процесса образуются ионы, которые свободно перемещаются в растворе. Диссоциация солей и оснований является обратимым процессом. Это означает, что ионы могут снова связываться и образовывать молекулы соли или основания.
Например, при диссоциации хлорида натрия (NaCl), соль расщепляется на ионы натрия (Na+) и ионы хлорида (Cl-). Таким образом, образуются два отдельных иона, которые свободно движутся в растворе.
Диссоциация солей и оснований играет важную роль в химических реакциях и растворимости веществ. Знание о процессе диссоциации помогает установить концентрацию ионов в растворе, а также понять поведение вещества в различных условиях.
Свойства солей и оснований

Сольные растворы могут обладать кислотно-щелочными свойствами. В зависимости от характера ионов в растворе, соли могут образовывать кислотные или щелочные растворы. Например, раствор соли карбоната натрия обладает щелочными свойствами, а раствор соли хлорида натрия имеет нейтральную реакцию.
Соли при нагревании или взаимодействии с кислотами могут проявлять реакцию диссоциации, то есть разлагаться на ионы. Это свойство играет важную роль в процессах химических реакций и позволяет использовать соли в качестве катализаторов и сырья для синтеза различных веществ.
Основания также обладают рядом уникальных свойств. Они способны реагировать с кислотами, образуя соль и воду. Реакция основания с кислотой называется нейтрализацией и является одним из способов использования оснований в химическом анализе и промышленности. Кроме того, основания являются электролитами и образуют щелочные растворы, которые широко используются в быту и на промышленных предприятиях.
Свойства солей и оснований делают их важными компонентами в различных сферах деятельности человека. Они находят применение в химической промышленности, медицине, пищевой промышленности и других отраслях науки и промышленности.
Какие химические соединения относятся к солям и основаниям?

Основания - это также химические соединения, но они образуются только от оснований. Они состоят из катиона (обычно металла или аммония) и группы гидроксила (OH). Например, гидроксид натрия (NaOH) - это основание, образованное реакцией между основанием натрия (Na) и гидроксид-ионом (OH).
Важно отметить, что соли и основания имеют различные свойства и применения. Соли могут быть использованы в пищевой промышленности, медицине и в других отраслях. Основания, с другой стороны, часто используются в стирке, химической промышленности и в других областях, где необходимо регулировать реакцию кислоты и основания.
Диссоциация солей

Диссоциация солей происходит в результате взаимодействия с водой, при котором тонкий слой водной оболочки окружает ионы соли и выталкивает их из кристаллической решетки. Это явление обусловлено полюсными свойствами воды, которая способна притягивать ионы соли.
Диссоциация солей имеет важное значение в химии, так как позволяет понять, какие ионы образуются при растворении солей и какие реакции могут происходить в растворе. Диссоциированные ионы могут образовывать новые соединения с различными реагентами и участвовать в химических реакциях.
| Примеры диссоциации солей: |
|---|
| NaCl → Na+ + Cl- |
| KNO3 → K+ + NO3- |
| MgCl2 → Mg2+ + 2Cl- |
| CuSO4 → Cu2+ + SO42- |
Образование ионов при диссоциации солей зависит от их химической формулы. В случае солей с однозначными ионами (например, NaCl) каждый ион образуется в полном объеме, в то время как у многозначных ионов (например, MgCl2) каждый ион может образоваться несколько раз.
Диссоциация солей является основным механизмом, за счёт которого соли растворяются в воде и образуют растворы, которые обладают электролитными свойствами. За счёт диссоциации солей возникает электрохимический потенциал и возможность проведения электрического тока в растворах электролитов.
Как происходит диссоциация солей в водном растворе?

Когда соль попадает в воду, молекулы воды начинают образовывать электростатические связи с ионами соли. Ионы соли разделяются на положительно и отрицательно заряженные ионы - катионы и анионы. Катионы обычно являются металлическими ионами, а анионы - неметаллическими.
В процессе диссоциации солей происходит разрушение ионной решетки соли, то есть отделение положительных и отрицательных ионов. Этот процесс можно представить в виде химической реакции, например:
NaCl(s) → Na+(aq) + Cl-(aq)
В этом примере, натрий хлорид (NaCl) диссоциирует в водный раствор, образуя натриевый и хлоридные ионы (Na+ и Cl- соответственно). Таким образом, диссоциация солей в водном растворе приводит к образованию свободно движущихся ионов, которые обеспечивают проводимость раствора и могут участвовать в различных химических реакциях.
Диссоциация оснований

NaOH → Na+ + OH-
В данном случае натриевое основание (NaOH) диссоциирует на ионы натрия (Na+) и гидроксидные ионы (OH-).
Диссоциация оснований также может происходить частично, при чем степень диссоциации зависит от концентрации и физико-химических свойств самого основания. Полностью диссоциированными считаются сильные основания, которые полностью отдают свои гидроксидные ионы.
Диссоциация оснований играет важнейшую роль в химических реакциях и имеет широкое применение в различных отраслях науки и промышленности.