Таблица Менделеева - незаменимый инструмент для изучения химических элементов. Она представляет собой упорядоченную систему из всех элементов, известных в настоящее время. Каждый элемент имеет свой номер, определенное название и символ, их свойства, атомную массу и иные характеристики. Все это обеспечивает удобство в работе с элементами и осуществление различных химических расчетов.
Номер элемента в таблице Менделеева является фактором, здесь заключается его важность и значение. Он отражает порядковый номер каждого элемента, в соответствии с его атомной массой. Номер элемента подчиняется некоторым правилам и зависит от его электронной структуры и места в периоде и группе.
Почему же номер в таблице Менделеева так важен? Он позволяет легко идентифицировать элемент, анализировать его химические и физические свойства, предсказывать тенденции и закономерности в их расположении в таблице. Номер элемента помогает ученым проводить исследования и разрабатывать новые материалы и соединения, на основе знаний о его свойствах и поведении.
Научная классификация элементов: таблица Менделеева

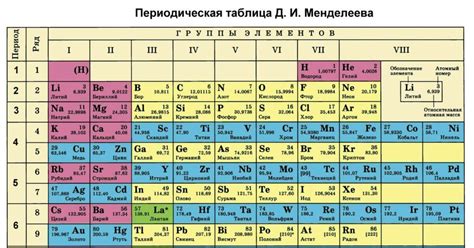
Таблица Менделеева организует элементы по атомному номеру, располагая их в порядке возрастания. Она включает все известные химические элементы, начиная с простейших водорода и гелия, и заканчивая самыми тяжелыми элементами, такими как унунтрий и унунквадиум.
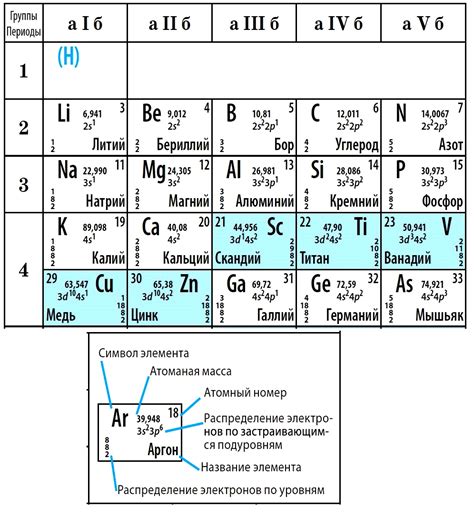
Каждый элемент в таблице Менделеева представлен своим символом, атомным номером и атомной массой. Элементы также классифицируются в группы и периоды в зависимости от состояния их электронной оболочки. Группы располагаются по вертикальной оси, а периоды - по горизонтальной.
Таблица Менделеева позволяет устранить хаос в огромном мире химических элементов и наглядно представить их свойства и взаимодействия. Она служит основой для многих научных исследований и помогает химикам и физикам в создании новых соединений и материалов.
Зависимость расположения элементов в таблице Менделеева от их свойств
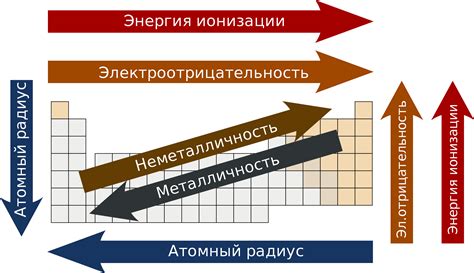
Главное свойство элементов, от которого зависит их расположение в таблице Менделеева, - это количество электронов в последней энергетической оболочке атома, так называемых валентных электронов. Этот параметр определяет химические свойства элементов. Число валентных электронов для каждого элемента определяется по номеру группы, в которой он находится.
Элементы одной группы имеют одинаковое число валентных электронов, что приводит к схожим химическим свойствам. Например, все элементы 1 группы, или щелочные металлы, имеют один валентный электрон и проявляют высокую реактивность. Следовательно, группы элементов в таблице Менделеева можно рассматривать как наборы элементов с схожими химическими свойствами.
Что касается периодов в таблице Менделеева, здесь наблюдается закономерность изменения химических свойств элементов при движении из одного периода в другой. Например, внутри периодов химические свойства постепенно изменяются от металлов к неметаллам. Переходные элементы, находящиеся между главными группами, обладают уникальными свойствами и способностью принимать разные степени окисления.
| Группа | Порядковый номер | Свойства элементов группы |
|---|---|---|
| 1 (I) | 1 | Валентный электрон: 1 Щелочные металлы, высокая реактивность |
| 2 (II) | 2 | Валентный электрон: 2 Щелочноземельные металлы, высокая реактивность, образуют ионы с зарядом +2 |
| 3-12 (III-VIII) | 3-12 | Переходные элементы, способность принимать разные степени окисления |
| 13 (III) | 13 | Валентный электрон: 3 Бор, алюминий, галлий и др. |
| 14 (IV) | 14 | Валентный электрон: 4 Кремний, германий, олово и др. |
| 15 (V) | 15 | Валентный электрон: 5 Азот, фосфор, антимон и др. |
| 16 (VI) | 16 | Валентный электрон: 6 Кислород, сера, селен и др. |
| 17 (VII) | 17 | Валентный электрон: 7 Галогены, высокая реактивность, образуют ионы с зарядом -1 |
| 18 (VIII) | 18 | Валентные электроны: 8 Благородные газы, низкая реактивность |
Таким образом, расположение элементов в таблице Менделеева является результатом сложной и точной зависимости от их свойств. Анализирование этой зависимости позволяет систематизировать и предсказывать химическую активность и другие свойства элементов.
Влияние атомного номера на свойства элементов
Атомный номер элемента определяет его положение в таблице Менделеева и имеет важное влияние на его свойства.
1. Атомный радиус: с увеличением атомного номера, атомный радиус элементов уменьшается. Это связано с увеличением притяжения ядра к внешним электронам.
2. Электроотрицательность: по мере увеличения атомного номера, электроотрицательность элементов в целом возрастает. Это объясняется более сильным притяжением ядра к электронам.
3. Температура плавления и кипения: обычно с увеличением атомного номера температура плавления и кипения элементов также увеличивается. Это связано с более сложной структурой атомов и более сильными межатомными связями.
4. Положение в периодической системе: атомный номер также определяет положение элемента в периодической системе. Это позволяет предсказывать некоторые общие свойства элементов в пределах одной группы или периода.
5. Активность: с увеличением атомного номера, элементы обычно становятся более активными на химические реакции. Это связано с увеличением энергии электронов во внешней оболочке.
В целом, атомный номер является важным фактором, определяющим свойства элементов и их поведение в химических реакциях. Изучение этой зависимости помогает прогнозировать свойства новых элементов и их использование в различных областях науки и промышленности.
Взаимосвязь между электронной конфигурацией и положением элементов в таблице
Электронная конфигурация элемента определяет количество электронов в его атоме и их распределение по энергетическим уровням и подуровням. Каждый энергетический уровень представляет собой главный квантовый числовой состояние электрона, а подуровни описывают форму его орбитали.
Положение элемента в таблице Менделеева определяется их электронной конфигурацией и, в частности, количеством электронных подуровней (s, p, d, f) внешней оболочки атома. Так, элементы, расположенные в одной группе, имеют одинаковое количество электронных подуровней в своих внешних оболочках.
Внешние электронные оболочки атомов элементов имеют большую энергетическую стабильность, поэтому свойства элементов в одной группе часто схожи между собой. Например, элементы группы 17, такие как фтор (F), хлор (Cl) и бром (Br), имеют схожие химические свойства из-за наличия семи электронов во внешней p-подобной оболочке.
| Группа | Название | Подуровни внешней оболочки |
|---|---|---|
| 1 | Щелочные металлы | s |
| 2 | Щелочно-земельные металлы | s |
| 13 | Борные металлы | p |
| 17 | Галогены | p |
| 18 | Благородные газы | p |
| 3-12 | Переходные металлы | d |
| 57-71 | Лантаноиды | f |
| 89-103 | Актиноиды | f |
Таким образом, взаимосвязь электронной конфигурации и положения элементов в таблице Менделеева позволяет упорядочить элементы в логическую систему, учитывая их строение и свойства.
Роль количества электронных оболочек в расстановке элементов
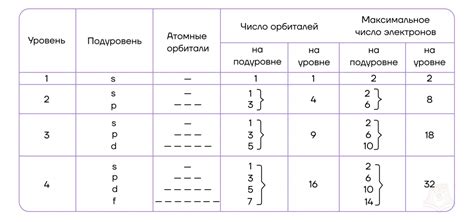
Электронные оболочки представляют собой энергетические уровни, на которых располагаются электроны. Их количество может варьироваться от одной до нескольких. Внешняя оболочка, также называемая валентной оболочкой, является наиболее значимой при реакциях элементов.
Расположение элементов в таблице Менделеева основано на принципе возрастания порядкового номера и электронной конфигурации. По мере увеличения атомного номера, количество электронов и электронных оболочек также увеличивается.
Важно отметить, что элементы с одинаковым количеством электронных оболочек обладают схожими химическими свойствами и находятся в вертикальных группах. Например, все элементы первой группы (алкалии) имеют одну электронную оболочку, а элементы восьмой группы (инертные газы) имеют полностью заполненную внешнюю оболочку.
Количество электронных оболочек играет важную роль в определении химических свойств элементов, и, следовательно, в их положении в таблице Менделеева.
Факторы, определяющие состав искусственно созданных элементов

- Выбор исходных материалов: для создания новых элементов исследователи используют различные радиоактивные и нестабильные изотопы, которые могут быть получены путем облучения стабильных элементов или синтеза в ядерных реакторах.
- Условия эксперимента: температура, давление, концентрация реагентов и другие условия влияют на химические реакции и процессы синтеза новых элементов.
- Элементы, используемые в качестве искусственных элементов, могут быть представлены разными группами и периодами периодической системы. В зависимости от комбинации элементов можно получать различные искусственные элементы.
- Используемые методы синтеза: существует несколько методов синтеза искусственных элементов, таких как ядерные реакции, синтез с использованием ускорителей частиц и синтез в искусственном ядерном реакторе.
- Длительность и стадии синтеза: создание искусственных элементов может занимать продолжительное время и включать несколько стадий, таких как облучение, экстракция, очистка и идентификация нового элемента.
Все эти факторы влияют на состав искусственных элементов и изучение зависимости между ними позволяет расширять наши знания о строении и свойствах новых элементов.
Взаимосвязь между химическими свойствами и местоположением элементов в таблице
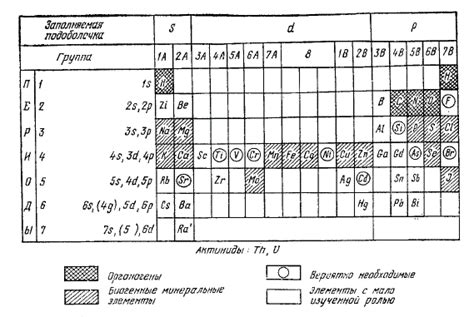
Периоды таблицы Менделеева представляют собой горизонтальные строки, которые связаны с энергетическими уровнями электронов в атоме. Чем выше в таблице элемент находится, тем больше энергетических уровней у его атома. Из этого следует, что элементы одного периода имеют сходные свойства, так как их атомы имеют одинаковое число энергетических уровней.
Группы таблицы Менделеева представляют собой вертикальные столбцы, которые связаны с числом электронов на внешнем энергетическом уровне. Внешний энергетический уровень электронов определяет валентность элемента и его способность к химическим реакциям. Элементы одной группы имеют одинаковое число электронов на внешнем энергетическом уровне и, следовательно, схожие химические свойства.
С помощью таблицы Менделеева можно легко определить основные химические свойства элементов и их возможные соединения. Например, легко видеть, что хлор (Cl) и фтор (F), находящиеся в одной группе, имеют схожие химические свойства и могут образовывать схожие соединения (например, с содружественными элементами).
Таблица Менделеева позволяет увидеть систематические зависимости между местоположением элементов и их химическими свойствами. Это значительно облегчает изучение химии и позволяет прогнозировать реакции между элементами и их соединениями. Понимание этих связей является ключевым для прогресса в химической науке и применения химии в различных областях науки и техники.
Применение таблицы Менделеева для прогнозирования свойств новых элементов:
Применение таблицы Менделеева для прогнозирования свойств новых элементов является важной задачей в современной химии. С помощью этой таблицы ученые могут предсказать какие химические реакции могут происходить с новыми элементами, а также определить их физические свойства, такие как плотность, температура плавления и кипения, атомный радиус и т. д.
Прогнозирование свойств новых элементов с использованием таблицы Менделеева имеет большое значение для различных отраслей науки и техники. На основе этих прогнозов можно разрабатывать новые материалы с уникальными свойствами, улучшать технологические процессы и создавать инновационные продукты.
Таким образом, таблица Менделеева является не только важным инструментом для классификации элементов, но и мощным инструментом для прогнозирования свойств новых элементов. Использование этой таблицы позволяет ученым находить новые знания и вносить вклад в развитие химической науки в целом.