Атомная масса - часто используемый термин в химии, который указывает на массу атома элемента. В соединении атомная масса вещества может быть вычислена путем сложения атомных масс каждого элемента, участвующего в составе соединения. Это важное понятие помогает химикам определить количество вещества в реакции, создать уравнения реакций и предсказывать исход химических процессов.
При вычислении атомной массы вещества необходимо учитывать относительные атомные массы элементов, выраженные в атомных единицах массы (аму). Относительная атомная масса каждого элемента указана в периодической системе химических элементов и является средним значением массы атомов этого элемента в природе, учитывая их изотопы и их относительные пропорции.
Для вычисления атомной массы вещества в соединении необходимо умножить относительную атомную массу каждого элемента на число атомов этого элемента в молекуле соединения, а затем сложить полученные значения для всех элементов. Это позволит получить общую атомную массу вещества в соединении. Зная общую атомную массу и количество вещества в соединении, можно вычислить массу конкретного вещества, а также провести различные расчеты и анализы.
Определение атомной массы вещества

Чтобы определить атомную массу вещества, необходимо учитывать относительную массу каждого атома в соединении и их количество. Для этого необходимо знать химическую формулу соединения.
Шаги для определения атомной массы вещества:
- Найти химическую формулу соединения.
- Определить относительную атомную массу (молярную массу) каждого атома в соединении. Обычно эти данные указываются в химических таблицах.
- Умножить относительные массы атомов на их количество в соединении.
- Сложить полученные произведения для всех атомов в соединении.
Таким образом, определяется атомная масса вещества. Эта величина может быть использована для рассчета других химических параметров, таких как молярная масса, количество вещества и молярные доли вещества.
Система единиц измерения
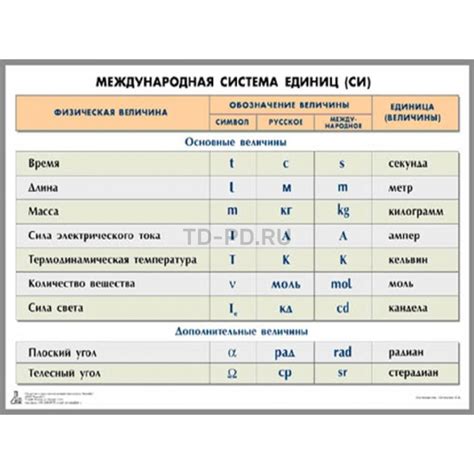
Другой распространенной единицей измерения в химии является грамм на моль (г/моль), которая представляет собой массу вещества, выраженную в граммах, содержащуюся в одном моле атомов, молекул или частиц вещества.
Кроме того, существуют также единицы измерения атомной массы, используемые в рамках конкретных областей химии. Например, в ядерной химии принята единица - атомная единица массы (а.е.м.), которая равна 1/12 массы атома углерода-12 и служит для измерения массы ядра атома.
Для удобства приведения единиц массы, часто используется таблица приведения атомных масс веществ к г/моль. В такой таблице приведены значения атомных масс элементов и их соединений, выраженные в г/моль.
| Вещество | Молярная масса (г/моль) |
|---|---|
| Водород (H) | 1.008 |
| Кислород (O) | 16.00 |
| Углерод (C) | 12.01 |
| Азот (N) | 14.01 |
| Железо (Fe) | 55.85 |
Методы определения атомной массы
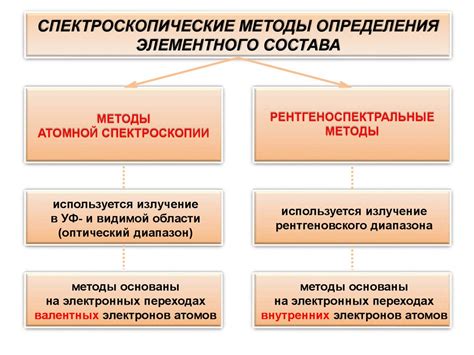
Один из методов определения атомной массы вещества основан на использовании масс-спектрометрии. Этот метод позволяет определить массу одного атома путем измерения отношения массы атома к заряду. Масс-спектрометрия использует ускорение и разделение атомов в магнитном поле, что позволяет определить их отношение массы к заряду. Использование масс-спектрометрии обеспечивает высокую точность результатов.
Другим методом определения атомной массы вещества является метод химического анализа. С помощью различных химических реакций и измерений массы реагирующих веществ можно определить отношение массы атомов в соединении. Например, методом гравиметрического анализа можно определить массу одного определенного элемента в соединении.
Дополнительно, существуют методы определения атомной массы с использованием рентгеновских лучей и ядерной магнитной резонансной спектроскопии. Эти методы основаны на взаимодействии атомов с электромагнитным излучением и позволяют определить атомную массу с высокой точностью.
Определение атомной массы вещества в соединении является важным шагом в химическом исследовании. Использование различных методов позволяет получить точные результаты и более глубокое понимание химической структуры вещества.
Изотопы и их роль в определении атомной массы
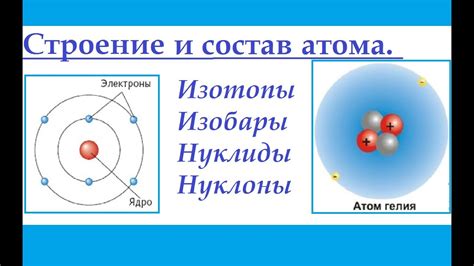
Изотопы представляют собой варианты атомов элемента, которые отличаются по числу нейтронов в ядре. Изотопы могут иметь одинаковое количество протонов и электронов, но отличаться по массе. Например, углерод может существовать в трех изотопических формах: углерод-12 (12С), углерод-13 (13С) и углерод-14 (14С).
Изотоп с наиболее распространенной массой называется основным или стабильным изотопом элемента. Другие изотопы элемента, имеющие различную массу, называются радиоактивными изотопами.
Изотопы играют важную роль в определении атомной массы вещества. При расчете атомной массы учитывается как количество каждого изотопа, так и его относительная масса. Для этого применяются специальные таблицы, в которых указаны относительные взаимные пропорции изотопов в природе. Например, атомная масса углерода, приведенная в периодической системе элементов, равна средней массе атомов его изотопов, взятой с учетом их относительного содержания.
Формула для расчета атомной массы вещества

Атомная масса вещества вычисляется с помощью следующей формулы:
- Найдите атомную массу каждого элемента, входящего в соединение. Атомная масса указывается на периодической таблице химических элементов.
- Умножьте атомную массу каждого элемента на количество атомов данного элемента в молекуле соединения.
- Сложите полученные произведения.
Например, чтобы найти атомную массу воды (H2O), нужно выполнить следующие шаги:
- Найдем атомные массы элементов воды: масса водорода (H) равна 1.007 г/моль, а масса кислорода (O) равна 15.999 г/моль.
- Умножим массу водорода на его количество в молекуле воды - 2 (H2) и массу кислорода на его количество - 1 (O).
- Сложим полученные произведения: (1.007 г/моль * 2) + (15.999 г/моль * 1) = 18.015 г/моль.
Таким образом, атомная масса воды равна 18.015 г/моль.
Примеры расчета атомной массы различных веществ

Расчет атомной массы вещества в соединении может быть сложным процессом, но с помощью правильных формул и данных о количестве и типах атомов в молекуле, можно получить точные результаты. Для наглядности рассмотрим несколько примеров:
| Вещество | Молекулярная формула | Атомная масса (г/моль) |
|---|---|---|
| Вода | H2O | 18.01528 |
| Углекислый газ | CO2 | 44.0095 |
| Aммиак | NH3 | 17.031 |
| Кальций хлористый | CaCl2 | 110.98 |
Это лишь некоторые примеры расчета атомной массы вещества. Для более сложных соединений, включающих большое количество атомов, необходимо провести более тщательные вычисления. Однако эти примеры демонстрируют, что расчет атомной массы вещества является важным и неотъемлемым шагом в химических расчетах.
Применение атомной массы вещества

Атомная масса вещества играет важную роль в различных аспектах научных и практических исследований. Она позволяет определить соотношение массы и количества атомов в соединении, что имеет большое значение для понимания его свойств и реакций.
Одним из главных применений атомной массы является расчет молярной массы вещества. Молярная масса выражает отношение массы вещества к количеству вещества в нем и измеряется в г/моль. Зная молярную массу вещества, можно вычислить необходимое количество вещества для проведения реакции или получения определенного продукта.
Атомная масса также используется для определения процентного содержания элементов в химических соединениях. Путем вычисления массовой доли каждого элемента и различных расчетов можно установить стехиометрическую формулу вещества и его состав.
Кроме того, атомная масса вещества играет роль в знакомой нам химической таблице Менделеева. В этой таблице элементы располагаются в порядке возрастания атомной массы, что свидетельствует о связи между структурой атома и его химическими свойствами.
Атомная масса является ключевым понятием в изучении различных наук, таких как химия, физика и материаловедение. Правильное использование и понимание атомной массы вещества позволяет углубить знания о его структуре, свойствах и взаимодействиях с другими веществами. Это является основой для научных исследований и разработки новых материалов и технологий.