Нейтроны являются одной из основных частиц атомного ядра, влияющих на его структуру и свойства. Знание количества нейтронов в атоме может быть полезным как для научных исследований, так и в промышленности или медицине. В этой статье мы рассмотрим основные методы определения количества нейтронов и подробно разберем их принципы и применение.
Первый метод определения количества нейтронов в атоме основан на знании его атомной массы и заряда. Для этого необходимо учитывать, что атомная масса атома представляет собой сумму его протонов и нейтронов. Зная атомную массу элемента и его заряд, можно вычислить количество протонов (равное заряду атома) и, вычитая их из общего числа нуклонов, определить количество нейтронов.
Второй метод основан на принципе радиоактивного распада. Многие изотопы элементов обладают радиоактивными свойствами, то есть они подвергаются спонтанному распаду со временем. Зная период полураспада вещества и изучая его радиоактивность, можно определить количество нейтронов в атоме. Для этого используются специальные методы и приборы, позволяющие измерять радиацию и анализировать периоды полураспада различных изотопов.
Третий метод определения количества нейтронов в атоме основан на использовании модернизированных инструментов и технологий, таких как нейтронное рассеяние, рефлексия и захват. Эти методы позволяют непосредственно измерить рассеяние нейтронов на атомных ядрах и определить их количество. Такие исследования проводят на специальных возможностях, например, в нейтронных реакторах и ускорителях частиц.
Определение количества нейтронов в атоме является важной задачей в физике и химии. Точные результаты этих определений позволяют более глубоко изучать свойства элементов, строить модели атомных ядер и разрабатывать новые материалы и технологии. При этом каждый из методов имеет свои преимущества и ограничения, поэтому выбор того или иного способа зависит от конкретной задачи и доступности соответствующего оборудования.
Массовое число и атомный номер
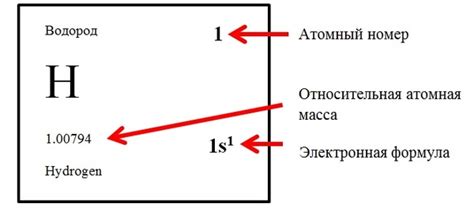
При изучении атомов и их структуры важно понять, что каждый атом характеризуется своим массовым числом и атомным номером. Эти два параметра позволяют узнать количество нейтронов в атоме и определить полную массу атома.
Массовое число (A) представляет собой сумму протонов и нейтронов в атомном ядре. Протоны носят положительный заряд и определяют химические свойства атома, а нейтроны не обладают зарядом и отвечают за стабильность ядра. Чтобы узнать количество нейтронов в атоме, нужно вычесть атомный номер (Z) из массового числа (A). Таким образом, количество нейтронов можно выразить формулой: нейтроны = массовое число - атомный номер.
Атомный номер (Z) представляет собой количество протонов в атоме и определяет его положение в периодической системе химических элементов. Каждый химический элемент имеет уникальный атомный номер, и он неизменен для атома данного элемента. Атомы с разным атомным номером являются атомами разных элементов, имеющих различные химические свойства.
Зная массовое число и атомный номер, можно определить количество нейтронов в атоме и вычислить его относительную атомную массу. Эти параметры являются основой для понимания строения атома и его химических свойств.
Использование периодической таблицы
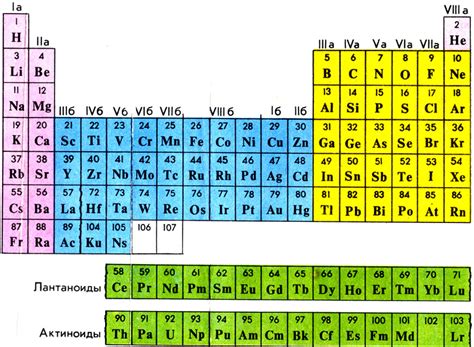
Чтобы узнать количество нейтронов в атоме, необходимо найти информацию о конкретном элементе в таблице. Атомный номер элемента указывает на число протонов в ядре, а также на число электронов в оболочках. Для определения количества нейтронов необходимо найти массовое число элемента.
Массовое число элемента указывает на общее количество протонов и нейтронов в ядре. Оно записывается в верхней части ячейки таблицы или под основным символом элемента. Например, для атома кислорода (O) массовое число равно 16.
Для определения количества нейтронов в атоме необходимо вычесть из массового числа атомного номера. В случае кислорода, у которого атомный номер равен 8, получается 16 - 8 = 8. Таким образом, в атоме кислорода содержится 8 нейтронов.
Использование периодической таблицы позволяет узнать количество нейтронов в атоме различных элементов. Отличительные свойства элементов также отражены в таблице, что делает ее незаменимым инструментом в изучении химии и определении состава атомов.
Изотопы и их свойства
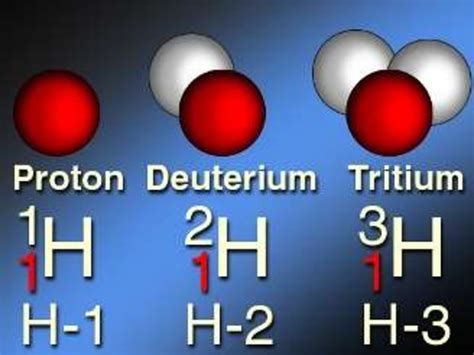
Каждый изотоп обладает уникальными свойствами. Число нейтронов в ядре влияет на массу атома, тем самым определяя его изотопическую массу. Изотопическая масса указывается в периодической таблице химических элементов и может отличаться от атомной массы, так как последняя усредняет массы всех изотопов элемента и учитывает их процентное содержание на Земле.
Изотопы также имеют различные степени стабильности. Некоторые изотопы являются стабильными и не подвержены распаду, в то время как другие могут распадаться с течением времени. Распад изотопов может быть радиоактивным или стабильным. Радиоактивные изотопы могут излучать различные виды радиации и использоваться в различных науках и промышленности, например, в медицине для диагностики и лечения различных заболеваний.
Изучение изотопов и их свойств позволяет нам лучше понять различные аспекты атомной структуры и процессов, происходящих в мире вокруг нас. Это важная область исследований, которая находит применение в различных научных и технических областях, а также имеет практическое значение для нашей повседневной жизни.
Использование масс-спектрометрии
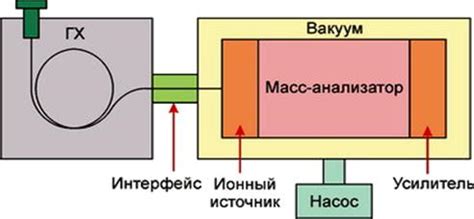
Процесс масс-спектрометрии начинается с ионизации атомов образца, при которой нейтральные атомы становятся положительно или отрицательно заряженными ионами. Затем, ионы попадают в магнитное поле, которое отклоняет их на определенный угол в зависимости от их заряда и массы.
Далее, ионы попадают на детектор, который регистрирует их приход. Используя данные о силе магнитного поля, угле отклонения и других факторах, можно определить отношение массы атомов к их заряду. Зная заряд ионов, можно рассчитать массу атома и, соответственно, количество нейтронов в нем.
Масс-спектрометрия является очень точным методом определения количества нейтронов в атоме. Она широко применяется в научных исследованиях, а также в промышленности, например, при анализе состава материалов и определении изотопного состава веществ. Этот метод также может быть полезным при изучении реакций ядерного синтеза и при обнаружении радиоактивных элементов.
| Преимущества масс-спектрометрии: | Недостатки масс-спектрометрии: |
|---|---|
| Высокая точность и чувствительность | Требует специализированного оборудования |
| Возможность анализа различных типов образцов | Требует подготовки образца |
| Широкий диапазон ионных масс | Дорогой метод анализа |
Расчет количества нейтронов по электронной конфигурации

Начните с записи электронной конфигурации атома. Электронная конфигурация может быть представлена в виде нотации, где каждый электронный орбитальный уровень обозначается буквой английского алфавита (например, s, p, d, f) и числом, которое указывает на количество электронов на этом уровне. Например, электронная конфигурация кислорода - 1s2 2s2 2p4.
После записи электронной конфигурации определите количество электронов, находящихся на энергетических уровнях s, p, d и f, а затем суммируйте их. В данном примере для кислорода есть 2 электрона на уровне s и 4 электрона на уровне p, что дает общее количество электронов равное 6.
Чтобы вычислить количество нейтронов, узнайте атомную массу элемента. Атомная масса - это сумма протонов и нейтронов в ядре атома. В периодической системе элементов можно найти атомную массу для каждого элемента.
Вычтите количество протонов из атомной массы, чтобы узнать количество нейтронов. Так как протоны и нейтроны имеют практически одинаковую массу, разность между атомной массой и количеством протонов даст приближенное значение количества нейтронов. Например, для кислорода с атомной массой 16, количество протонов равно 8. Разница между атомной массой и количеством протонов составляет 8, что является приближенным количеством нейтронов в атоме кислорода.
Этот метод позволяет определить приближенное количество нейтронов в атоме на основе его электронной конфигурации и атомной массы.