Химия является одной из самых непредсказуемых и сложных наук, но понимание основных правил ионных уравнений поможет вам справиться с любым химическим уравнением. Ионные уравнения играют важную роль в описании химических реакций и позволяют наглядно представить, как ионы веществ взаимодействуют между собой.
Основное правило составления ионного уравнения заключается в разделении химического вещества на ионы и записи каждого иона отдельно. Таким образом, если у вас есть реакция, в которой взаимодействуют два вещества, то вы должны разделить каждое вещество на ионы и учесть знаки зарядов каждого иона.
Важно помнить, что в ионном уравнении нужно сохранять баланс массы и заряда, то есть количество положительных и отрицательных ионов должно быть одинаковым с обеих сторон уравнения. Часто при составлении ионных уравнений используются таблицы реакций, которые помогают определить, какие ионы могут образовываться в результате химической реакции.
Примеры ионных уравнений могут включать реакции, такие как образование азотида натрия (Na+ + N3- → Na3N) или реакцию между серной кислотой и гидроксидом натрия (H2SO4 + 2NaOH → Na2SO4 + 2H2O) и многие другие.
Принципы составления ионного уравнения

Ионное уравнение представляет собой химическое уравнение, в котором отображаются ионы, участвующие в химической реакции. Для составления ионного уравнения необходимо следовать ряду принципов:
1. Разложение всех реагентов на ионы. В ионном уравнении необходимо указать все ионы, образующиеся из реагентов. Обычно растворяются в воде, поэтому в качестве реагентов могут быть использованы соли, кислоты или основания.
2. Запись ионных формул. После разложения реагентов на ионы, необходимо записать формулу каждого иона. Положительные ионы записываются справа, а отрицательные – слева от стрелки реакции.
3. Учет стехиометрии. Для правильного составления ионного уравнения необходимо учитывать соотношение между ионами в реакционной среде. Для этого следует указывать соответствующие коэффициенты перед формулами ионов.
4. Аннигиляция ионов. При составлении ионного уравнения необходимо учитывать возможность аннигиляции ионов, то есть их сокращение и исключение из уравнения, если они одновременно являются продуктами и реагентами.
Применение этих принципов позволяет составить ионное уравнение, отображающее химическую реакцию с учетом образования ионов. Важно отметить, что ионное уравнение является дополнительным способом записи химической реакции и позволяет более подробно представить происходящие процессы.
Определение ионного уравнения

Для составления ионного уравнения необходимо знать, какие ионы присутствуют вводных и продуктах реакции. Описание состояния веществ осуществляется путем записи соответствующего физического состояния с использованием значков в скобках: (г) - газ, (ж) - жидкость, (тв) - твердое вещество и (а) - водный раствор.
Чтобы записать ионное уравнение, необходимо разделить реакцию на две полуреакции: окисление (потеря электронов) и восстановление (получение электронов). Каждая активная частица записывается отдельно, соответственно ее заряду и физическому состоянию.
Затем обе полуреакции объединяются с учетом того, что общее количество зарядов в реакции должно быть сбалансировано (заряды должны быть одинаковыми на обеих сторонах уравнения).
| Пример: | Ионное уравнение: |
|---|---|
| Цинк (тв) + серная кислота (а) | Zn^2+ (а) + H2SO4 (а) → Zn^2+ (а) + SO4^2− (а) + H2 (г) |
Таким образом, определение ионного уравнения позволяет более подробно описать процесс химической реакции, отображая образующиеся и исчезающие ионы, а также состояние веществ.
Шаги для составления ионного уравнения

Шаг 1: Определите реагенты, которые участвуют в химической реакции. Прежде всего, вам нужно знать, какие химические вещества будут реагировать.
Пример: Кальций (Ca) реагирует с хлором (Cl2).
Шаг 2: Запишите ионные формулы для каждого реагента и определите заряды ионы, образованные каждым из них.
Пример: Катионный ион Ca2+ и анионный ион Cl-.
Шаг 3: Составьте ионное уравнение, выравнивая заряды ионов.
Пример: Ca2+ + 2Cl- → CaCl2.
Шаг 4: Проверьте уравнение на балансировку количества атомов каждого элемента.
Пример: Ca + Cl2 → CaCl2.
Шаг 5: Проверьте уравнение на балансировку зарядов.
Пример: Ca + Cl2 → CaCl2 (уравнение сбалансировано).
Шаг 6: Запишите окончательное ионное уравнение.
Пример: Ca + Cl2 → CaCl2.
Это примерная последовательность шагов для составления ионного уравнения в химии. Для сложных реакций, содержащих больше реагентов или продуктов, могут понадобиться дополнительные шаги интерпретации и сбалансировки уравнения.
Примеры решения ионных уравнений
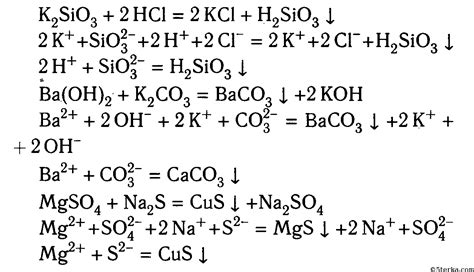
Рассмотрим несколько примеров, чтобы лучше понять, как составлять и решать ионные уравнения в химии.
Пример 1:
Рассмотрим реакцию между хлоридом натрия (NaCl) и серной кислотой (H2SO4). Сначала мы должны расписать данные химические вещества на ионы.
NaCl -> Na+ + Cl-
H2SO4 -> 2H+ + SO42-
Затем мы записываем реакцию в виде ионного уравнения:
Na+ + Cl- + 2H+ + SO42- -> 2Na+ + 2Cl- + H2O + SO42-
Это ионное уравнение показывает, что ионы Na+ и Cl- образуют соль NaCl, а ионы H+ и SO42- образуют серную кислоту H2SO4. Также в реакции образуется вода (H2O).
Пример 2:
Рассмотрим реакцию между хлоридом серебра (AgCl) и нитратом натрия (NaNO3). Начнем с расписывания веществ на ионы:
AgCl -> Ag+ + Cl-
NaNO3 -> Na+ + NO3-
Полученные ионы запишем в виде ионного уравнения:
Ag+ + Cl- + Na+ + NO3- -> AgCl + Na+ + NO3-
В данной реакции ионы Ag+ и Cl- образуют хлорид серебра AgCl. Ионы Na+ и NO3- останутся без изменений.
Таким образом, решение ионных уравнений позволяет лучше понять, как происходят реакции между веществами и какие ионы образуются в результате. Это особенно полезно при изучении химии и проведении химических экспериментов.
Реакция между кислотой и основанием

Для составления ионного уравнения реакции между кислотой и основанием необходимо знать ионообразующие способности данных соединений. Кислоты образуют положительные ионы водорода (H+), а основания образуют отрицательные ионы гидроксида (OH-).
Примером реакции между кислотой и основанием может служить реакция нейтрализации соляной кислоты и гидроксида натрия:
| Ионные формулы реагентов | Ионные формулы продуктов |
|---|---|
| H+ + Cl- | Na+ + OH- |
В результате реакции образуются натриевая соль (NaCl) и вода (H2O). Ионное уравнение данной реакции будет выглядеть следующим образом:
H+ + Cl- + Na+ + OH- → Na+ + Cl- + H2O
Таким образом, реакция между кислотой и основанием представляет собой процесс образования соли и воды, при котором ионы водорода и гидроксида соединяются в молекулы воды, а ионы металла и анионы кислоты образуют соль.
Реакция образования соли
- Кислота + Основание → Соль + Вода
Например, при реакции раствора соляной кислоты (HCl) с раствором гидроксида натрия (NaOH) образуется соль - хлорид натрия (NaCl) и вода:
- HCl + NaOH → NaCl + H2O
В данной реакции ионы водорода (H+) из кислоты обмениваются с ионами гидроксида (OH-) из основания, образуя соль NaCl и молекулы воды. При этом, ионы водорода и ионы гидроксида нейтрализуются, а в результате реакции получается соль и вода.
- Важно помнить!
При записи ионного уравнения необходимо правильно указывать заряды ионы, а также балансировать уравнение по количеству атомов каждого элемента.
Конечно, это только один из примеров реакции образования соли. В химии существует множество других реакций, при которых образуется соль. Но независимо от конкретного вида реакции, правила и принципы составления ионного уравнения в каждом случае остаются одинаковыми.
Окислительно-восстановительная реакция

Окислитель - вещество, которое получает электроны и в результате становится восстановленным, при этом само окисляется.
Восстановитель - вещество, которое отдает электроны и в результате становится окисленным, при этом само восстанавливается.
Окислительно-восстановительные реакции играют важную роль в химических процессах, так как они позволяют превращать одно вещество в другое с помощью электронных переходов, что может сопровождаться выделением энергии или использованием ее для преобразования других веществ.
Одним из примеров окислительно-восстановительной реакции является реакция горения. В этом процессе окислителем является кислород, который получает электроны от веществ, содержащих углерод, в результате чего происходит окисление углерода до оксида углерода или углеродного диоксида. Восстановителем при этом выступает углерод, который отдает электроны и сам восстанавливается.
Окислительно-восстановительные реакции можно представить в виде ионных уравнений, в которых отображаются ионы, участвующие в реакции и их изменение окислительного состояния.
Правила решения ионных уравнений

- Изучите начальные вещества. Запишите формулы и ионообразная формула каждого вещества.
- Запишите перед начальными веществами символы, указывающие их фазы. Например, (g) для газа, (l) для жидкости, (s) для твердого вещества и (aq) для раствора.
- Разделите ионные соединения на катионы и анионы. Запишите формулы ионов для каждого соединения.
- Установите, какие ионы остаются неизменными в химической реакции и являются ионами-наблюдателями. Они не участвуют в реакции и остаются без изменений на протяжении всей реакции.
- Запишите ионы, которые участвуют в реакции, идентифицируя реагенты и продукты.
- Убедитесь, что сумма зарядов ионов в соединениях совпадает до и после реакции. Объедините соединения, чтобы суммарный заряд всех ионов в реакции был равен нулю.
- Запишите уравнение реакции, располагая ионы и соединения в правильном порядке.
- Проверьте уравнение реакции на сбалансированность, чтобы количество атомов каждого элемента было одинаковым как слева, так и справа.
- Обозначьте все получившиеся ионы, фазы и знак реакции (если известно).
Составление и решение ионных уравнений требует практики и понимания основных правил химии. Следуя этим правилам, вы сможете разобраться в молекулярных реакциях и получить полное представление о них.
Запись ионных уравнений в соответствии с зарядами
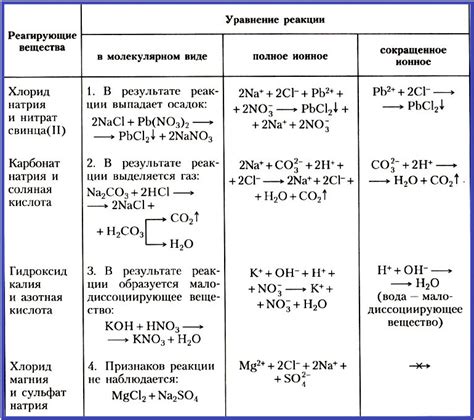
Составление ионного уравнения в химии требует учета зарядов ионов, чтобы правильно отразить происходящие химические реакции. Заряд иона указывает на положительное или отрицательное электрическое состояние вещества.
При составлении ионного уравнения необходимо учитывать следующие правила:
- Запись ионов происходит в виде символов со знаком, обозначающим заряд. Заряд положительного иона указывается после знака плюс (+), а заряд отрицательного иона - после знака минус (-).
- Общая сумма зарядов положительных ионов должна быть равна общей сумме зарядов отрицательных ионов, чтобы сохранить электрическую нейтральность системы.
- Если ионы вещества находятся в растворе, необходимо указать их состояние с помощью добавления индексов: (aq) - для растворенных ионов или (s) - для ионов в твердом состоянии.
- Ионы, участвующие в реакции, должны быть правильно балансированы, чтобы обеспечить сохранение массы вещества и заряда.
Например, рассмотрим реакцию между хлоридом натрия (NaCl) и нитратом серебра (AgNO3):
NaCl(aq) + AgNO3(aq) → AgCl(s) + NaNO3(aq)
В данной реакции хлорид натрия и нитрат серебра реагируют, образуя хлорид серебра и нитрат натрия. Заряды ионов правильно отражены в уравнении, а также указано состояние ионов в растворе или твердом состоянии.
Правильная запись ионных уравнений с учетом зарядов помогает понять, как происходят химические реакции и какие соединения образуются в результате. Это необходимое умение для изучения химии и понимания ее основных принципов.