Аккумулятор – это устройство, которое используется для хранения и отдачи электрической энергии. Оно стало незаменимым в нашей повседневной жизни, ведь благодаря аккумулятору мы можем пользоваться различными портативными устройствами, такими как мобильные телефоны, планшеты и ноутбуки, не подключая их к электросети.
Но как же устроен аккумулятор и как он работает?
Внутри аккумулятора находятся два электрода – положительный и отрицательный. Между ними находится электролит, который служит для проведения электрического тока. Когда аккумулятор находится в рабочем состоянии, электроды подключены к внешней цепи и начинают протекать химические реакции.
Что такое аккумулятор и как он работает?

Он состоит из нескольких частей:
- Анода: отрицательного электрода, который обеспечивает постоянное поступление электронов в цепь;
- Катода: положительного электрода, на который идут электроны и происходят реакции с электролитом;
- Электролита: раствора, который обеспечивает передвижение ионов;
- Разъема: для подключения аккумулятора к другим устройствам.
Работа аккумулятора основана на электрохимических реакциях между электродами и электролитом. Во время зарядки, аккумулятор подключается к внешнему источнику электрической энергии, и происходит обратимая химическая реакция, в результате которой аккумулируется энергия.
При использовании аккумулятора, энергия высвобождается: электроны начинают двигаться от анода к катоду через внешнюю цепь, создавая электрический ток, который может быть использован в устройствах.
Самыми распространенными типами аккумуляторов являются свинцово-кислотные и литиево-ионные. Каждый из них имеет свои преимущества и недостатки, и выбор зависит от конкретных требований и потребностей.
Принцип работы аккумулятора
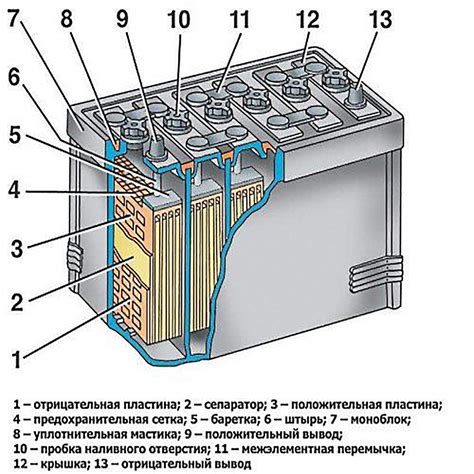
Работа аккумулятора основана на реакциях окисления-восстановления, которые происходят на электродах. Во время зарядки аккумулятора электрический ток вызывает перераспределение ионов внутри аккумулятора. Положительные ионы перемещаются к отрицательному электроду, а отрицательные – к положительному. Это вызывает изменение состояния веществ электродов.
Когда аккумулятор подключается к электрической цепи, происходит обратный процесс – ионы начинают перемещаться в противоположном направлении. В результате на электродах происходят химические реакции, которые выделяют электрическую энергию.
Принцип работы аккумулятора основан на том, что процессы химических реакций могут быть обратимыми. То есть, аккумулятор можно зарядить и разрядить множество раз, при этом он сохраняет свои электрические свойства. Благодаря этому аккумуляторы являются удобным источником энергии для различных устройств, таких как мобильные телефоны, ноутбуки и многие другие.
Основные компоненты аккумулятора
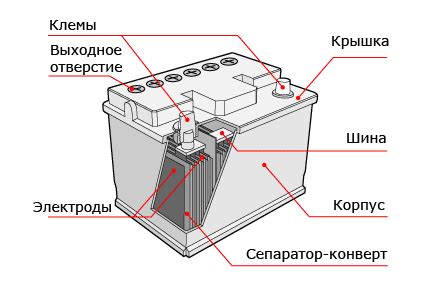
1. Анод: анод – это один из электродов аккумулятора и представляет собой материал, способный отдавать электроны во время химических реакций. В большинстве аккумуляторов в качестве анода используется свинец или свинцовая сплава. Атомы свинца могут отдавать электроны, чтобы создавать электрический ток.
2. Катод: катод – это другой электрод аккумулятора, который принимает электроны во время химических реакций. В качестве катода обычно используется материал, который содержит группу металлов, таких как никель или кобальт.
3. Электролит: электролит – это вещество, которое позволяет электронам двигаться между анодом и катодом. Обычно электролит представляет собой гель или раствор, состоящий из солей и других химических соединений. Электролит играет важную роль в работе аккумулятора, поскольку он обеспечивает проводность электронов и ионов между анодом и катодом.
Сочетание этих трех компонентов позволяет аккумулятору функционировать и хранить электрическую энергию до тех пор, пока она не будет использована в устройствах и схемах, требующих питания.
Химические реакции в аккумуляторе
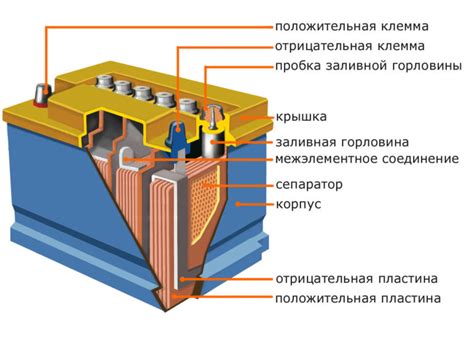
Внутри аккумулятора обычно содержатся два электрода - положительный и отрицательный. Между ними находится электролит, который позволяет ионам перемещаться между электродами и провести электрический заряд.
При зарядке аккумулятора происходят следующие химические реакции:
1. На положительном электроде происходит окислительная реакция, в результате которой ионы положительного заряда (катионы) соединяются с электродом и принимают электроны от источника заряда.
2. На отрицательном электроде происходит восстановительная реакция, где электроны от источника заряда передаются на ионы отрицательного заряда (анионы) и связываются с электродом.
В процессе разрядки аккумулятора происходят обратные химические реакции:
1. На положительном электроде происходит восстановительная реакция, где ионы положительного заряда возвращаются в электролит, а связанные с электродом электроны передаются на источник разряда.
2. На отрицательном электроде происходит окислительная реакция, ионы отрицательного заряда возвращаются в электролит, а связанные с электродом электроны принимают от источника разряда.
Таким образом, в процессе зарядки и разрядки аккумулятора происходят электрохимические реакции, позволяющие хранить и переводить электрическую энергию.
Различные типы аккумуляторов

Существует несколько различных типов аккумуляторов, каждый из которых имеет свои особенности и применение:
1. Свинцово-кислотные аккумуляторы (СКА). Этот тип аккумуляторов широко распространен и используется в автомобильной и бытовой технике. Они состоят из свинцовых пластин, разделенных электролитом из серной кислоты. СКА являются недорогими, но имеют низкую энергетическую плотность и требуют регулярной замены электролита.
2. Литий-ионные аккумуляторы (Li-ion). Эти аккумуляторы являются самыми распространенными в мобильных телефонах, но они также используются в ноутбуках, электроинструментах и электромобилях. Они обладают высокой энергетической плотностью, небольшими размерами и малым весом. Однако они имеют ограниченную срок службы и могут быстро разрядиться при частых перезарядках.
3. Никель-кадмиевые аккумуляторы (NiCd). Эти аккумуляторы были широко использованы в прошлом, но сейчас они заменяются более современными технологиями из-за высокого содержания кадмия, который является опасным веществом. Они обладают высокой степенью устойчивости к перезарядке, но имеют меньшую энергетическую плотность по сравнению с литий-ионными аккумуляторами.
4. Никель-металл-гидридные аккумуляторы (NiMH). Этот тип аккумуляторов является более экологически безопасной альтернативой никель-кадмиевым аккумуляторам, но имеет и более высокую энергетическую плотность. Они широко используются в портативных электронных устройствах, таких как фотоаппараты, игровые приставки и электробритвы.
Как аккумулятор заряжается и разряжается?

Процесс зарядки аккумулятора начинается, когда его подключают к источнику электрической энергии, например, к электрической розетке или к солнечной батарее. Во время зарядки происходит химическая реакция, в результате которой происходит накопление электрической энергии.
Внутри аккумулятора есть два электрода: положительный и отрицательный. При зарядке на положительном электроде происходит окисление вещества, а на отрицательном – восстановление. Это позволяет накапливать энергию.
Когда аккумулятор используется и выдает электрическую энергию, процесс обратный. Во время разрядки происходят обратные химические реакции, в результате которых энергия освобождается и передается по проводам в электрическую цепь.
Оптимально заряжать аккумулятор до определенного уровня, так как частое перезаряжание и переполнение электролита может негативно повлиять на его работу и продолжительность службы.
Поэтому аккумуляторы имеют специальные контроллеры и сенсоры, которые контролируют процесс зарядки и разрядки, чтобы обеспечить безопасную и эффективную работу устройства.
| Процесс зарядки аккумулятора | Процесс разрядки аккумулятора |
|---|---|
| Происходит химическая реакция, в результате которой накапливается электрическая энергия. | Происходят обратные химические реакции, энергия освобождается и передается по проводам в электрическую цепь. |
| Максимальный уровень заряда аккумулятора должен быть оптимальным, чтобы не повредить устройство. | При использовании аккумулятора его заряд постепенно снижается. |
| Зарядка осуществляется подключением аккумулятора к источнику электрической энергии. | Разрядка происходит во время использования аккумулятора для питания электрического устройства. |
Срок службы аккумулятора и его перезарядка
Срок службы аккумулятора зависит от нескольких факторов, включая качество батареи и интенсивность ее использования. Как правило, средний срок службы аккумулятора составляет около 3-4 лет. Однако, если правильно следить за зарядкой и использовать аккумулятор рационально, его срок службы может быть значительно продлен.
Перезарядка аккумулятора происходит с помощью зарядного устройства. Для эффективной перезарядки рекомендуется использовать зарядное устройство, которое предназначено специально для данного типа аккумулятора. Оно обеспечивает оптимальные условия зарядки, чтобы аккумулятор работал наиболее эффективно и не был поврежден.
При перезарядке аккумулятора необходимо следить за тем, чтобы он не был перезаряжен или перегрет. Перезарядка аккумулятора до 100% заряда не рекомендуется, так как это может привести к его перегреву и сократить срок его службы. Рекомендуется оставлять аккумулятор на зарядке до 80-90%.
Кроме того, важно не полностью разряжать аккумулятор, особенно до того уровня, когда устройство отключается. Это также может негативно сказаться на его сроке службы. Рекомендуется заряжать аккумулятор, когда его заряд падает до 20-30%, чтобы сохранить его работоспособность.
Важно помнить, что аккумуляторы могут иметь ограниченное количество циклов зарядки-разрядки. Поэтому, если устройство работает от аккумулятора, рекомендуется периодически подключать его к источнику питания, чтобы сохранить его заряд и продлить срок службы. Также осторожно следует обращаться с аккумулятором и избегать падений или ударов, чтобы не повредить его.
Применение аккумуляторов в повседневной жизни

Одно из самых распространенных применений аккумуляторов - это использование их в электронных устройствах, таких как мобильные телефоны, ноутбуки, планшеты и фотокамеры. Аккумуляторы позволяют нам использовать эти устройства без подключения к сети электропитания, что делает их мобильными и удобными в использовании.
Аккумуляторы также широко используются в автомобильной промышленности. Они питают стартеры и системы зажигания автомобилей, а также предоставляют энергию для электроники и освещения. Благодаря аккумуляторам мы можем запускать двигатели автомобилей и использовать их электронные системы даже при отсутствии подключения к электросети.
Другое важное применение аккумуляторов - это хранение энергии из возобновляемых источников, таких как солнечные и ветровые электростанции. Солнечные панели и ветряные турбины генерируют электрическую энергию, которая запасается в аккумуляторах и используется в тех местах и в то время, когда энергопотребление самого источника невозможно.
Кроме того, аккумуляторы находят применение в медицинской технике, особенно в портативных медицинских устройствах, таких как инфузионные насосы, ЭКГ-аппараты и дефибрилляторы. Они обеспечивают надежное питание этих устройств и позволяют лечить пациентов в любом месте и в любое время.
Использование аккумуляторов также включает в себя области, такие как аэрокосмическая промышленность, возобновляемая энергетика, системы резервного питания и многое другое. Благодаря постоянному развитию новых технологий аккумуляторы становятся все более эффективными и долговечными, что позволяет им находить все большее применение в нашей повседневной жизни.
Правила безопасности при использовании аккумуляторов

Во-первых, регулярно проверяйте состояние аккумулятора. При обнаружении трещин, любых повреждений или утечек электролита аккумулятор следует заменить или отремонтировать. Также необходимо следить за уровнем электролита и при необходимости доливать дистиллированную воду. Аккумуляторы должны быть хорошо закреплены и не должны смещаться во время использования.
Во-вторых, никогда не заряжайте аккумуляторы вблизи легковоспламеняющихся веществ или на поверхностях, которые могут загореться. Запрещено хранить аккумуляторы в близости от открытого огня или в условиях повышенной температуры. Также не следует подвергать аккумуляторы механическим ударам и деформациям.
В-третьих, не разбирайте аккумуляторы самостоятельно. Если у вас возникли какие-либо проблемы с аккумулятором, обратитесь к специалистам или авторизованному сервисному центру. Неправильное разбирание аккумулятора может привести к утечке электролита и представлять опасность для здоровья.
И последнее, помните, что аккумуляторы содержат химические вещества, поэтому не рекомендуется использовать их вблизи детей или животных. Если внутрь аккумулятора попала жидкость, немедленно промойте зону контакта водой и обратитесь за медицинской помощью.
Следуя этим простым правилам безопасности, вы сможете наслаждаться использованием аккумуляторов безопасно и без каких-либо проблем.