Электронная конфигурация является основополагающим понятием в химии, которое позволяет определить распределение электронов в атоме или ионе. Изучение электронной конфигурации помогает понять, какие элементы обладают химической активностью и каким образом они взаимодействуют друг с другом.
Основные правила для составления электронной конфигурации основываются на принципе заполнения энергетических уровней и подуровней электронами. Согласно правилу "спинового заполнения", на каждом энергетическом уровне электроны сначала заполняют подуровни с минимальной энергией.
Существуют несколько шаблонов для записи электронной конфигурации. Например, конфигурация атома натрия можно записать как 1s2 2s2 2p6 3s1. Здесь цифры указывают количество электронов на каждом подуровне, а буквенные обозначения обозначают энергетические уровни и подуровни: s - уровень, p - подуровень.
Определение электронной конфигурации
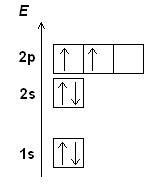
Электронная конфигурация записывается в форме чисел и букв, где число указывает на энергетический уровень, а буква - на подуровень и орбиталь. Например, конфигурация атома гелия (He) - 1s2, что означает, что на первом энергетическом уровне в подуровне s находятся два электрона.
При определении электронной конфигурации следует придерживаться следующих правил:
- Принцип заполнения: электроны заполняют энергетические уровни с наименьшей энергией.
- Принцип Паули: на орбиталь могут находиться максимум два электрона с противоположным спином.
- Принцип Хунда: электроны заполняют орбитали одного энергетического уровня, равномерно распределяясь по подуровням перед заполнением следующего уровня.
Например, электронная конфигурация атома кислорода (O) - 1s2 2s2 2p4, что означает, что на первом энергетическом уровне есть два электрона, на втором энергетическом уровне - два электрона в подуровне s и четыре электрона в подуровне p.
Определение электронной конфигурации позволяет предсказывать химическую активность элементов и их способность образовывать соединения с другими элементами.
Значение электронной конфигурации в химии
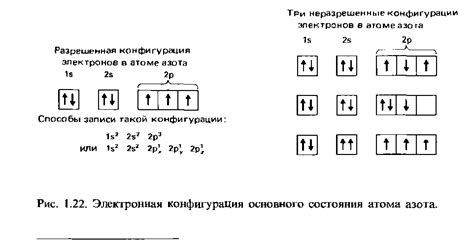
Электронная конфигурация позволяет определить, какие уровни энергии заполнены электронами и насколько атом стабилен. Атомы стремятся заполнить свои энергетические уровни, чтобы достичь наиболее стабильного состояния – конфигурации с полностью заполненными подуровнями. Это объясняет химическую активность и схему реакций атомов и молекул.
Электронная конфигурация также влияет на физические и химические свойства веществ. Например, электронная конфигурация определяет, как атомы соединяются между собой, образуя химические связи. Кроме того, различные электронные конфигурации могут определять свойства атома или иона, такие как магнитные или электрические свойства.
Электронная конфигурация может быть представлена в виде химической нотации с использованием символов элементов и обозначения энергетических уровней и подуровней. Например, электронная конфигурация кислорода может быть записана как 1s2 2s2 2p4, где цифры указывают количество электронов на каждом энергетическом уровне и символы обозначают подуровни.
| Подуровень | Обозначение |
|---|---|
| 1s | 1 электрон |
| 2s | 2 электрона |
| 2p | 4 электрона |
Электронная конфигурация может быть определена с помощью периодической системы элементов и правил заполнения энергетических уровней и подуровней. Например, электронная конфигурация атома кислорода может быть определена на основе его положения в периодической системе и заполнения энергетических уровней и подуровней.
Изучение электронной конфигурации позволяет лучше понять структуру и свойства атомов и молекул, а также является основой для понимания межатомных взаимодействий и реакций в химии.
Правила для построения электронной конфигурации

2. Правило Конфигурационного блока: Разрешается заполнять орбитали одного энергетического уровня только после полного заполнения предыдущего уровня.
3. Правило Ауфбау: Электроны заполняют орбитали по возрастанию их энергии.
4. Правило Паули: Два электрона, занимающих одну орбиталь, должны иметь разные спины - будь то "вверх" или "вниз".
5. Правило Гунда: Атомы с 4 или большим числом электронов внешней оболочки предпочитают иметь полузаполненные или полностью заполненные подуровни. Например, атомы кислорода и фтора образуют отрицательные ионы O- и F-, чтобы достичь полностью заполненной электронной оболочки.
Квантовое число главного уровня (n)

Значение квантового числа главного уровня может быть любым положительным целым числом, начиная с 1. Принципиально, чем больше значение квантового числа главного уровня, тем выше энергия электрона.
Квантовое число главного уровня позволяет определить количество электронных подуровней на каждом главном уровне. Каждый главный уровень содержит n подуровней, где n - значение квантового числа главного уровня.
Примеры значений квантового числа главного уровня:
- n = 1: первый главный уровень, содержащий 1 подуровень (s-подуровень);
- n = 2: второй главный уровень, содержащий 2 подуровня (s-подуровень и p-подуровень);
- n = 3: третий главный уровень, содержащий 3 подуровня (s-подуровень, p-подуровень и d-подуровень);
- n = 4: четвертый главный уровень, содержащий 4 подуровня (s-подуровень, p-подуровень, d-подуровень и f-подуровень).
Зная значение квантового числа главного уровня и количество подуровней на каждом главном уровне, можно составить электронную конфигурацию атома и определить распределение электронов по подуровням.
Azimuthal quantum number
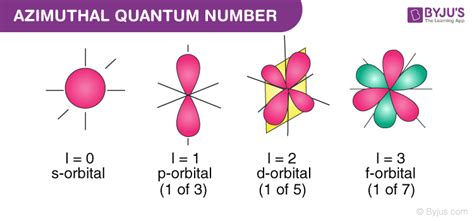
Значение азимутального квантового числа может быть от 0 до (n-1), где n - главное квантовое число. Каждое значение азимутального квантового числа соответствует своей форме орбитали:
- l = 0 - s-орбиталь, имеет сферическую форму
- l = 1 - p-орбиталь, имеет форму шестилистника
- l = 2 - d-орбиталь, имеет форму двухшестеренки
- l = 3 - f-орбиталь, имеет сложную форму
Чем больше значение азимутального квантового числа, тем более сложная форма орбитали. Азимутальное квантовое число также влияет на энергию орбитали: орбитали с более высокими значениями азимутального квантового числа имеют более высокую энергию.
Азимутальное квантовое число используется вместе с главным квантовым числом (n) и магнитным квантовым числом (m) для полного описания орбитали и электронной конфигурации атома.
Magnetic quantum number
Магнитное квантовое число обозначается буквой m и принимает значения от -l до +l, где l - орбитальное квантовое число. Диапазон значений m определяет количество возможных ориентаций орбитали в пространстве.
Диаграмма Хунда - метод, используемый для определения электронной конфигурации и распределения электронов по орбиталям. Для заполнения орбиталей электронами используются правила Афбау, Паули и Хунда.
Магнитное квантовое число позволяет определить ориентацию орбитали в пространстве. Наличие электрона с разными значениями m в одной орбитали означает, что эти электроны находятся в разных магнитных подуровнях этой орбитали.
Знание магнитного квантового числа важно для понимания структуры атома и его электронной конфигурации. Оно помогает определить расположение электронов в орбиталях и влияет на химические свойства атома.
Spin quantum number

Квантовое число спина может принимать два возможных значения: 1/2 и -1/2. Эти значения соответствуют двум направлениям, в которых спин электрона может быть ориентирован относительно внешнего магнитного поля.
Спин электрона является внутренним свойством и не имеет аналога в классической механике. Он играет важную роль в определении электронной структуры атома и взаимодействии электронов между собой.
Значение квантового числа спина определяется правилами заполнения электронных орбиталей. По правилу Паули, в одном атоме могут находиться максимум два электрона с противоположными спинами. Это означает, что в каждой электронной орбитали может находиться только один электрон с определенным направлением спина.
Квантовое число спина в комбинации с другими квантовыми числами (главным, орбитальным и магнитным) определяет полную электронную конфигурацию атома и его химические свойства.
Правило заполнения энергетических уровней

Электронные уровни в атоме заполняются согласно принципам, которые определены правилом заполнения энергетических уровней. Оно позволяет определить порядок заполнения орбиталей для различных элементов в периодической системе.
Правило устанавливает следующие принципы:
- Электроны заполняют орбитали одного энергетического уровня до заполнения орбиталей последующего уровня.
- Сначала заполняются орбитали с более низкой энергией, а потом – орбитали с более высокой энергией.
- Понижение энергии совместно заполняемых орбиталей происходит с увеличением главного квантового числа n и уменьшением значения побочного квантового числа l.
- Каждая орбиталь может вместить максимум два электрона с противоположными спинами.
- Заполнение орбиталей происходит в соответствии с принципом минимизации энергии.
- Орбитали с одинаковым значением главного квантового числа n и побочным квантовым числом l заполняются по возрастанию значения магнитного квантового числа ml.
Эти правила помогают определить электронную конфигурацию атома и знать, каким образом заполняются орбитали различных энергетических уровней. Они являются основой для построения электронных структур элементов в периодической системе.
Примеры электронной конфигурации
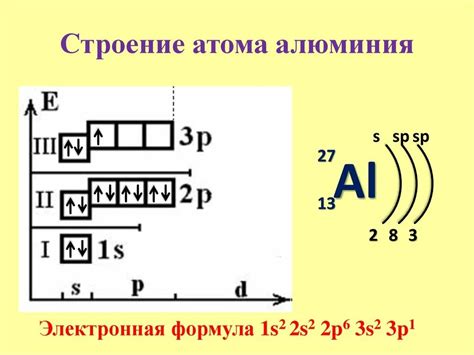
Для лучшего понимания процесса построения электронной конфигурации рассмотрим несколько примеров:
Пример 1:
Атом гелия имеет два электрона. Первый электрон занимает первую энергетическую оболочку, а второй электрон - вторую энергетическую оболочку. Поэтому электронная конфигурация атома гелия будет обозначаться как 1s2.
Пример 2:
Атом кислорода имеет восемь электронов. Первые два электрона занимают первую энергетическую оболочку (1s2), следующие шесть электронов занимают вторую энергетическую оболочку. Первые четыре электрона располагаются в отдельных орбиталях (2s2), а оставшиеся два электрона занимают орбиталь с одиноким электроном (2p4). Таким образом, электронная конфигурация атома кислорода будет обозначаться как 1s2 2s2 2p4.
Пример 3:
Атом железа имеет 26 электронов. Первые два электрона занимают первую энергетическую оболочку (1s2). Следующих восемь электронов располагаются на второй энергетической оболочке (2s2 2p6). Девять электронов занимают третью энергетическую оболочку (3s2 3p6). Четыре электрона располагаются на четвертой энергетической оболочке (3d4). Таким образом, электронная конфигурация атома железа будет обозначаться как 1s2 2s2 2p6 3s2 3p6 3d4.
Приведенные примеры демонстрируют, что строение электронных оболочек и электронная конфигурация определяются количеством электронов и закономерностями устройства атомов.
Электронная конфигурация атома гелия

Электронная конфигурация атома гелия описывает распределение электронов по энергетическим уровням и подуровням вокруг ядра атома.
Атом гелия имеет атомный номер 2, что означает наличие двух электронов в его электронной оболочке. Первый электрон заполняет первый энергетический уровень - K-уровень, а второй электрон заполняет второй энергетический уровень - L-уровень.
Электронная конфигурация атома гелия можно записать следующим образом:
1s2.
Здесь 1s обозначает энергетический уровень и подуровень, а в верхнем индексе указано количество электронов на данном уровне. Для атома гелия оба электрона находятся на первом энергетическом уровне и в подуровне s.
Электронная конфигурация атома гелия показывает его стабильность и низкую реактивность, так как все энергетические уровни закрыты и заполнены электронами.
Атом гелия является инертным и стабильным элементом, что делает его полезным в различных областях, включая применение в аэростатике, в качестве защитного газа и в медицинской технике.
Электронная конфигурация атома кислорода
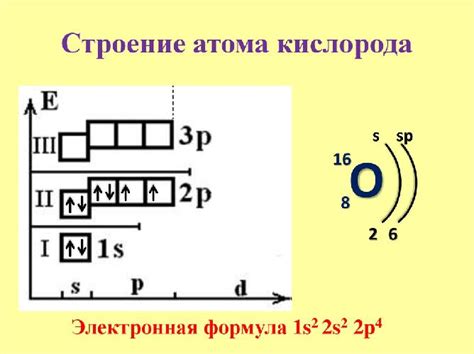
Конфигурация атома кислорода может быть записана в виде последовательности чисел и букв, обозначающих энергетический уровень и подуровень электронов. В общем виде она записывается в виде 1s2 2s2 2p4. Это означает, что у кислорода на первом энергетическом уровне находятся 2 электрона, на втором - также 2 электрона, а на третьем энергетическом уровне находятся 4 электрона в 2s и 2p подуровнях.
Энергетическое уровней и подуровней в атоме определено энергетическими уровнями электронов. Уровни обозначаются целыми числами (1, 2, 3, и т.д.), а подуровни - буквами латинского алфавита (s, p, d, f). Каждый уровень может содержать различное количество подуровней и электронов.
В таблице ниже представлено подробное распределение электронов атома кислорода:
| Энергетический уровень | Подуровни | Количество электронов |
|---|---|---|
| 1 | 1s | 2 |
| 2 | 2s | 2 |
| 2p | 4 |
Таким образом, электронная конфигурация атома кислорода можно записать как 1s2 2s2 2p4, где первый энергетический уровень содержит 2 электрона (1s2), второй уровень содержит 2 электрона (2s2), и третий уровень содержит 4 электрона (2p4).
Электронная конфигурация атома железа
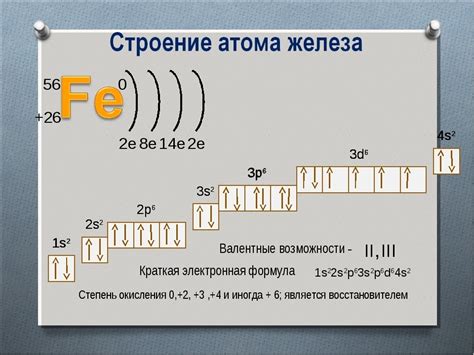
Атом железа содержит 26 электронов, которые распределены по различным энергетическим уровням и подэнергетическим оболочкам. Электронная конфигурация помогает нам понять, как эти электроны организованы вокруг ядра атома.
Первый энергетический уровень атома железа содержит 2 электрона, которые располагаются в его единственной подэнергетической оболочке - s-оболочке. Второй энергетический уровень также имеет 2 электрона, которые располагаются в его s-оболочке.
Третий энергетический уровень содержит 6 электронов, которые располагаются в s- и p-подоболочках. S-подоболочка третьего уровня содержит 2 электрона, а p-подоболочка содержит 6 электронов.
Итак, электронная конфигурация атома железа выглядит следующим образом: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Это значит, что у атома железа есть 2 электрона в первой подэнергетической оболочке, 2 электрона во второй подэнергетической оболочке, 6 электронов в третьей подэнергетической оболочке и 6 электронов в третьей подэнергетическом подуровне d-оболочки.
Электронная конфигурация атома железа является важной информацией, которая может быть использована для предсказания его химических свойств и реакций.