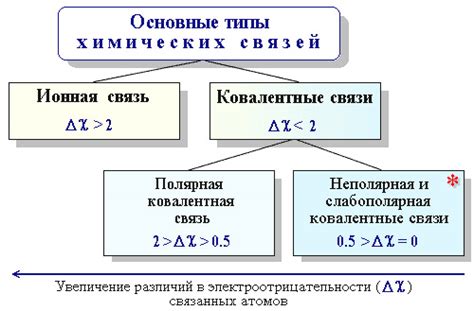
Химия – увлекательная наука, изучающая состав, строение и свойства вещества, а также превращения, которые происходят в нем. Визуальное представление молекул и химических соединений играет важную роль в химических исследованиях. Знание основных правил по рисованию связей является фундаментальным навыком для химиков.
Связи в химии отображаются в виде линий, которые указывают на наличие химической связи между атомами. Они позволяют понять, какие атомы являются составной частью молекулы и как они связаны между собой. Визуализация молекул и их связей помогает поляризовать химические реакции, составлять уравнения и предсказывать химические свойства вещества.
Основные правила по рисованию связей в химии включают:
1. Определение валентности атомов.
Каждый атом обладает определенной валентностью – числовым значением, означающим число связей, которое атом может образовать с другими атомами. Валентность восстанавливается с помощью периодической таблицы или уточненной информации.
2. Размещение атомов на плоскости.
При рисовании молекулы на плоскости необходимо учесть геометрию молекулы и расстояние между атомами. Поддерживай гармоничное расположение связей, обратив внимание на уже нарисованные атомы, радиусы валентных электронов и углы между атомами.
3. Правильное изображение связей.
Связи в химии рисуются прямыми или пунктирными линиями. Прямые связи обозначают обычные ковалентные связи или несвободные электроны, а пунктирные связи используются для обозначения кратных связей или нестабильных электронов. Кратные связи включают двойные и тройные связи.
Основные правила рисования связей в химии
1. Связь должна быть прямой и линейной. Для знакомых элементов, таких как углерод, кислород и азот, полагается использовать прямые линии для обозначения связей. Длина линий должна быть примерно одинаковой и должна быть достаточной для обеспечения видимости связи.
2. Количество связей должно соответствовать валентности элемента. Например, углерод обычно образует четыре связи, а кислород - две связи. Это правило помогает определить структуру молекулы и установить, какие атомы связаны между собой.
3. Соединения не должны пересекаться. При рисовании сложных структур необходимо стараться избегать пересечения связей, чтобы изображение было более читабельным и понятным.
4. Расположение атомов должно соответствовать их пространственной конфигурации. Например, атомы в трехмерных молекулах могут находиться в разных плоскостях, и это должно быть отражено в рисунке.
5. При наличии зарядов или особых связей используются соответствующие символы и обозначения, чтобы ясно показать эти химические свойства соединения. Например, положительный и отрицательный заряды могут быть указаны путем добавления плюса и минуса к атомам или угловым скобкам вокруг заряженной группы атомов.
Изучение и практика рисования связей в химии поможет улучшить понимание молекулярной структуры и реакций, а также позволит более эффективно общаться с другими химиками и представлять свои идеи. Хорошее изображение связей является важным инструментом в химической работе.
Правило правой руки
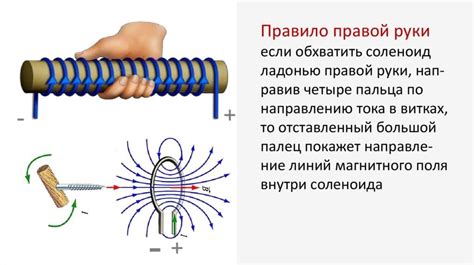
В химии существует удобное правило, называемое "правило правой руки", которое позволяет определить направление потока электронов в молекуле или ионе.
Суть правила заключается в следующем: если поместить ладонь правой руки так, чтобы большой палец указывал на ось связи между атомами, а остальные пальцы направлялись по направлению вдоль связи, то направление поворота мизинца будет указывать направление потока электронов. Если мизинец "указывает" в сторону одного из атомов, это означает, что электроны переносятся от другого атома к этому. Если мизинец "указывает" в обратном направлении, то электроны переносятся от данного атома к другому.
Правило правой руки широко применяется для определения направления потока электронов в различных химических реакциях, таких как реакции окисления-восстановления и взаимодействия кислот с основаниями.
Примечание: Правило правой руки не является единственным методом определения направления потока электронов, но оно является простым и удобным приближением для описания молекулярных процессов в химии.
Использование правила правой руки при рисовании молекул
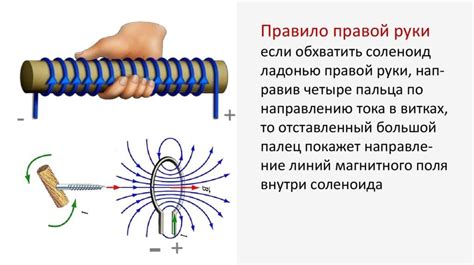
Для использования этого правила необходимо следовать нескольким шагам:
- Положите руку перед собой, вытяните указательный, средний и большой пальцы так, чтобы они были перпендикулярны друг другу.
- Направьте указательный палец вдоль одной из связей в молекуле, указывая от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью.
- Затем направьте средний палец перпендикулярно указательному пальцу, указывая в пространство в сторону атома с наибольшим количеством заместителей или более сложной группы.
- Наконец, большой палец должен быть направлен в противоположную сторону от вас, образуя трехмерную ось, называемую осью "зрения". Это определяет абсолютную конфигурацию молекулы.
Использование правила правой руки позволяет определить положение различных атомов, связей и групп в молекуле, что очень важно для понимания структуры и свойств химических соединений. Это правило активно применяется в органической химии, в особенности для определения абсолютной конфигурации хиральных молекул.
Правило октета
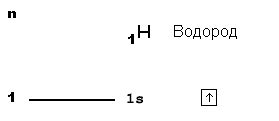
Если атом имеет электронную оболочку, заполненную полностью или почти полностью, он будет менее склонным к реакциям, так как у него уже есть стабильная конфигурация. Наиболее распространенной конфигурацией, удовлетворяющей правилу октета, является конфигурация эдагастрической октавы, когда атом образует шесть электронных связей и две несвязанные электронные пары.
Правило октета позволяет предсказывать типы химических связей и строение молекулы. Например, атомы, имеющие один или два электрона в валентной оболочке, будут образовывать ионические связи, атомы с тремя или пятью электронами в валентной оболочке будут образовывать координационные связи, а атомы со шестью или семью электронами будут образовывать ковалентные связи.
Правило октета является важным инструментом для понимания структуры и свойств химических соединений и играет важную роль в изучении органической и неорганической химии.
Объяснение правила октета при рисовании молекул
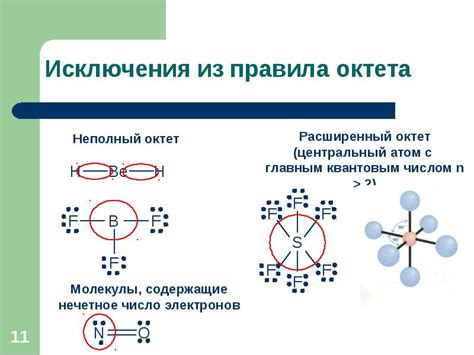
В химии внешняя электронная оболочка атома называется валентной оболочкой. Она содержит валентные электроны - те электроны, которые участвуют в химических реакциях. Валентные электроны определяют связи, которые атомы образуют друг с другом.
Когда мы рисуем молекулу, мы должны учитывать, что атомы стремятся иметь около себя восемь электронов во внешней оболочке. Это объясняется тем, что при наличии восьми электронов атом обретает наиболее стабильное состояние, а значит, наиболее низкую энергию.
Правило октета позволяет нам представить распределение электронов в молекуле, определить типы связей и удовлетворить потребности атомов в электронах, для достижения стабильного состояния.
Однако следует отметить, что не все атомы стремятся иметь около себя восемь электронов. Например, атомы водорода (H) и лития (Li) стремятся иметь около себя только 2 электрона во внешней оболочке, образуя так называемые дуплеты. Атомы, которые могут иметь больше восьми электронов во внешней оболочке, называются расширенными. К ним относятся атомы, находящиеся во втором периоде и более дальних периодах таблицы Менделеева.
Тем не менее, правило октета все же является полезным средством при рисовании структур молекул и добавляет понятности в изображении взаимосвязей между атомами.
Учет заряда

В химии при рисовании связей важно учитывать заряды атомов, так как они влияют на химические свойства вещества. Заряд атома указывается справа от его символа и представляет собой число со знаком. Заряд может быть положительным (+) или отрицательным (-), в зависимости от того, есть ли избыток или дефицит электронов у атома.
Если атом имеет положительный заряд, это означает, что у него больше протонов, чем электронов. Положительный заряд указывается числом со знаком "+" справа от символа атома. Например, атом натрия (Na) имеет положительный заряд +1, а значит, у него на один электрон меньше, чем протонов.
Если атом имеет отрицательный заряд, это означает, что у него больше электронов, чем протонов. Отрицательный заряд указывается числом со знаком "-" справа от символа атома. Например, атом кислорода (O) имеет отрицательный заряд -2, а значит, у него на два электрона больше, чем протонов.
При рисовании связей между атомами с разными зарядами необходимо учитывать, что они должны компенсироваться. Положительный заряд одного атома должен быть равен отрицательному заряду другого атома. Например, если атом натрия (Na) имеет заряд +1, то атом хлора (Cl) должен иметь заряд -1, чтобы заряды компенсировали друг друга.
Учет заряда при рисовании связей помогает понять, какие ионы могут образовывать и какие вещества имеют ионную связь. Кроме того, знание зарядов атомов позволяет предсказывать поведение вещества в химических реакциях.
Важность учета заряда при рисовании химических связей

При рисовании химических связей важно учитывать заряд атомов, так как заряд может оказывать существенное влияние на химические свойства вещества. Заряд атома определяется числом электронов, находящихся на его внешнем энергетическом уровне. Атомы могут иметь положительный (+) или отрицательный (-) заряд, а также быть нейтральными (0).
Учет заряда атомов особенно важен при построении ионных соединений. В ионных соединениях атомы обмениваются электронами, образуя положительно или отрицательно заряженные ионы. Рисование правильных связей между ионами позволяет визуализировать формулу ионного соединения и понять его химический состав.
При рисовании связей в органической химии также необходимо учитывать заряд атомов, особенно в случае функциональных групп. Функциональные группы - это группы атомов, связанных между собой с помощью химических связей и представляющих особую функцию в органическом соединении. Знание заряда функциональной группы позволяет понять ее реакционную способность и влияние на химическое поведение органического соединения.
Помимо ионных соединений и органических соединений, заряд атомов учитывается при рисовании координационных соединений, металлокомплексов, катионов и анионов. Знание заряда атомов позволяет корректно расположить их в пространстве и связать между собой, что является важным элементом в понимании структуры вещества и его свойств.
Важность учета заряда при рисовании химических связей заключается в возможности визуализации химической структуры соединения, понимания его свойств и реакционной способности. Правильное рисование связей с учетом заряда атомов помогает химикам анализировать, предсказывать и моделировать химические реакции и явления.
Смещение электронов
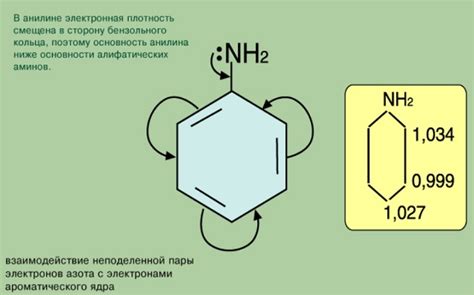
Главным фактором, влияющим на смещение электронов, является электроотрицательность атомов. Электроотрицательность – это способность атома притягивать к себе электроны. Атомы с большей электроотрицательностью имеют больше шансов привлечь к себе электроны и образовать отрицательно заряженные ионы или привлечь электроны к себе в химической связи.
Если атомы различной электроотрицательности образуют химическую связь, электроны могут быть смещены ближе к атому с большей электроотрицательностью. Это называется поляризацией связи. В результате поляризации электроны распределяются неравномерно и создается дипольный момент в молекуле.
Смещение электронов может привести к образованию различных типов связей. Если электроны полностью переносятся с одного атома на другой, образуется ионная связь. Если электроны смещаются частично, образуется полярная ковалентная связь. В случае, когда электроны не смещаются, образуется неполярная ковалентная связь.
Смещение электронов также может происходить в химических реакциях, когда происходит образование или разрыв химических связей. Это позволяет веществам проявлять химическую активность и участвовать в различных химических реакциях.
Как учитывать смещение электронов при рисовании связей
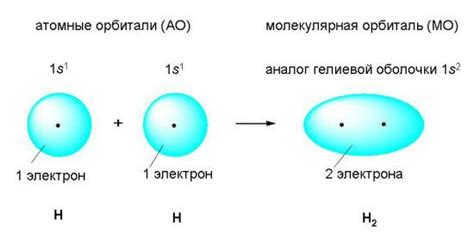
При рисовании связей в химических молекулах необходимо учитывать смещение электронов. Это позволяет более точно отобразить основные химические свойства вещества.
Смещение электронов, также известное как поляризацию связи, происходит из-за неравномерного распределения электронной плотности между атомами внутри молекулы. В результате этого один атом становится частично положительно заряженным (δ+) , а другой - частично отрицательно заряженным (δ-) .
Для отображения смещения электронов при рисовании связей используют стрелки, которые указывают направление электронного смещения. Стрелка начинается от более отрицательной части связи (δ-) и указывает на более положительную часть (δ+).
При рисовании связей важно помнить некоторые основные правила:
- Стрелка смещения электронов должна быть направлена от атома с большей электроотрицательностью к атому с меньшей электроотрицательностью. Направление стрелки соответствует направлению смещения электронной плотности.
- Смещение электронов можно отображать как с одной стороны связи в виде одной стрелки, так и с двух сторон связи в виде двух стрелок, указывающих в противоположные стороны.
- Учтите, что не все связи обладают поляризацией. Смещение электронов возникает только в случае наличия полярной связи, когда атомы имеют разные электроотрицательности.
Учитывая смещение электронов при рисовании связей, можно более точно отобразить молекулярную структуру и предсказать химическую активность вещества. Это важный аспект при изучении химии и решении химических задач.
Степень окисления

Вещества могут иметь положительную, отрицательную или нулевую степень окисления. Положительное значение означает, что атом отдаёт электроны, отрицательное значение означает, что атом принимает электроны, а нулевое значение означает, что атому не нужно ни отдавать, ни принимать электроны. Степень окисления определяет химическую активность атома и его возможность образования связей с другими атомами.
Для определения степени окисления атома в молекуле, следует учитывать его электроотрицательность и количество электронов во внешней оболочке. Например, водород (H) всегда имеет степень окисления +1, окислительная способность кислорода (O) обычно составляет -2, а щелочной металл (например, натрий Na) имеет степень окисления +1. Исключением являются пероксиды (например, перекись водорода), в которых кислород имеет степень окисления -1.
Знание степени окисления позволяет предсказать тип связи между атомами и раскрыть химические свойства вещества. Оно также помогает в определении электрохимической активности веществ и позволяет более точно прогнозировать реакции, которые могут произойти.
Как учитывать степень окисления при рисовании связей
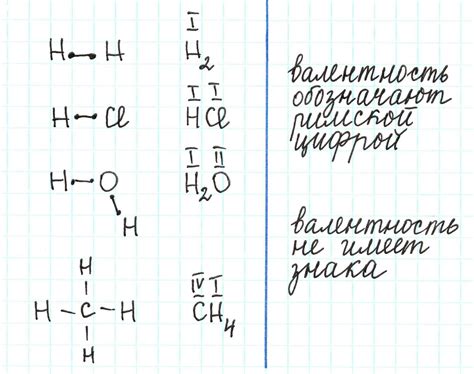
Вот несколько правил, которые следует учитывать:
- Если атом имеет положительную степень окисления, он должен быть обозначен плюсом (+). Например, атом кислорода в молекуле H2O имеет степень окисления -2, поэтому он будет обозначен как O (-2).
- Если атом имеет отрицательную степень окисления, он должен быть обозначен минусом (-). Например, атом водорода в молекуле H2O имеет степень окисления +1, поэтому он будет обозначен как H (+1).
- Связь между атомами должна быть нарисована так, чтобы количество электронов, переносимых в процессе образования связи, соответствовало разности степеней окисления атомов. Например, в молекуле H2O один атом кислорода имеет степень окисления -2, а два атома водорода - +1 каждый. Следовательно, между атомом кислорода и каждым атомом водорода будет нарисована связь, представляющая перенос двух электронов в процессе образования связи.
Учитывая степень окисления при рисовании связей, вы сможете правильно представить химические соединения и их свойства. Это позволит вам более полно понять и описать молекулярную структуру в химических реакциях и процессах.
Правило минимальной энергии

Согласно этому правилу, связи рисуются между атомами в таком положении, которое позволяет им находиться в состоянии с наименьшей энергией. Положение атомов в молекуле может быть определено на основе таких факторов, как длина связи и углы между связями.
Для определения положения атомов в молекуле можно использовать различные методы, такие как электронные структуры, валентные электронные распределения и теории химической связи.
- Электронные структуры позволяют определить положение атомов на основе их распределения электронов.
- Валентные электронные распределения представляют собой модели, описывающие распределение валентных электронов в молекуле.
- Теории химической связи, такие как теория Вальзера-Льюиса или теория Веспер, позволяют определить положения атомов и углы между связями на основе электронной структуры молекулы.
Важно помнить, что рисунок связей в химии – это всего лишь модель, которая помогает наглядно представить структуру молекулы. Правило минимальной энергии помогает выбрать наиболее стабильную конфигурацию атомов, но не является абсолютной истиной.