Определение основания химического соединения по его формуле является ключевым вопросом в химии. Основание – это элемент или группа элементов, которые имеют положительный заряд и приводят к образованию ионов. Для правильного определения основания необходимо учитывать строение молекулы соединения и заряд элементов, входящих в него.
Важно отметить, что основание может быть как одним элементом, так и соединением нескольких элементов. При определении основания по формуле необходимо обратить внимание на атомы, которые имеют положительный заряд. Для этого используются правила номенклатуры химических соединений.
Наиболее распространенными основаниями являются щелочи и щелочноземельные металлы. Они обладают высокой реактивностью и широко используются в промышленности. Щелочи, такие как натрий, калий и литий, образуют положительные ионы, легко реагирующие с другими химическими веществами.
Основание химического соединения
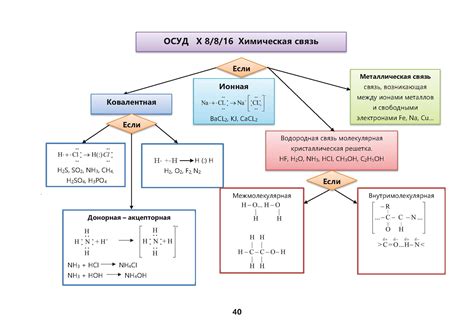
Определение основания химического соединения чрезвычайно важно для правильного понимания его свойств и реакций. При изучении химических соединений, особенно в органической химии, важно знать, какие атомы и молекулы служат основанием для образования данного соединения, поскольку они могут оказывать существенное влияние на его химические свойства.
Определение основания химического соединения может быть осуществлено путем анализа его химической формулы. В формуле соединения атомы элементов, участвующих в его образовании, приведены в определенной последовательности. Первый атом или группа атомов в формуле часто является основанием соединения. Например, водородное хлоридное соединение HCl имеет водород (H) в качестве основания, а хлорид (Cl) - второй элемент, который связан с основанием.
В некоторых случаях, основание химического соединения может быть определено исходя из его систематического наименования. Например, в нитрате аммония (NH4NO3) основанием является аммоний (NH4), тогда как нитрат (NO3) является группой, связанной с основанием.
Знание основания химического соединения позволяет определить его химические свойства, предсказать его реакционную способность и применение в различных областях науки и промышленности.
Определение формулы соединения

Определить формулу химического соединения можно на основе сведений о его составе. Формула составляется на основе элементов, из которых состоит соединение, и их количественного содержания вещества. В химической формуле элементы обозначаются символами, а их количество указывается индексами, расположенными справа от символов элементов.
Применяются различные методы для определения формулы соединения. Наиболее распространенный метод - анализ состава вещества. Для этого проводятся эксперименты, в которых устанавливается содержание каждого элемента в химическом соединении. По полученным данным рассчитывается количество элементов, необходимых для образования одной молекулы или единицы формулы соединения.
| Символ элемента | Индексы элемента |
|---|---|
| C | 12 |
| H | 1 |
| O | 16 |
Например, воду можно обозначить формулой H2O, что означает, что для образования одной молекулы воды необходимы два атома водорода и один атом кислорода. Если известна молярная масса вещества, можно определить количество частиц элементов в 1 моль соединения. Это позволяет составить формулу соединения на основе массы каждого элемента.
Компоненты химического соединения:
Химическое соединение образуется из атомов различных элементов, называемых компонентами. Каждый элемент обозначается символом из периодической таблицы элементов. Например, воду образуют атомы водорода (H) и атомы кислорода (O).
Количество атомов каждого элемента в химическом соединении определяется числовыми индексами, называемыми коэффициентами. Коэффициент перед символом элемента указывает на количество атомов данного элемента в соединении. Например, воду можно записать как H2O, что означает, что в молекуле воды присутствуют два атома водорода и один атом кислорода.
Состав химического соединения можно определить по его формуле. Формула химического соединения показывает, из каких элементов оно образовано и в каком соотношении. Например, формула воды (H2O) указывает, что соединение содержит два атома водорода и один атом кислорода.
Компоненты химического соединения могут быть разной природы и насыщенности. Некоторые химические соединения состоят только из атомов одного элемента, такие соединения называются простыми веществами. Например, кислород (O2), азот (N2), хлор (Cl2).
Другие химические соединения содержат атомы разных элементов и называются сложными веществами. Например, вода (H2O), серная кислота (H2SO4), углекислый газ (CO2).
Расчет молекулярной массы

Для расчета молекулярной массы необходимо знать атомные массы каждого элемента, присутствующего в формуле соединения. Обычно атомные массы указываются в таблице элементов Менделеева.
Чтобы рассчитать молекулярную массу, необходимо умножить атомную массу каждого элемента на количество атомов данного элемента в молекуле соединения. Затем полученные значения сложить.
Например, для расчета молекулярной массы воды (H2O) необходимо умножить атомную массу водорода (H) на 2 и прибавить к ней атомную массу кислорода (O).
Таким образом, расчет молекулярной массы является важным шагом в определении основания химического соединения по его формуле.
Идентификация функциональных групп

Для идентификации функциональных групп, можно воспользоваться таблицей, в которой указаны характерные признаки каждой группы и их расположение в молекуле.
| Функциональная группа | Характеристики и признаки | Расположение в молекуле |
|---|---|---|
| Карбонильная группа | Образована атомами углерода и кислорода, связанными двойной связью. Характерные соединения: альдегиды и кетоны. | Чаще всего располагается внутри молекулы, но может быть и на конце цепи углеродных атомов. |
| Гидроксильная группа | Образована атомами кислорода и водорода. Характерные соединения: спирты и кислоты. | Обычно располагается на конце углеродной цепи, внутри кольца или замещает атом водорода в органической молекуле. |
| Аминогруппа | Содержит атом азота, связанный с углеродной цепью или кольцом. Характерные соединения: амины и амиды. | Может располагаться на конце углеродной цепи или быть внутри молекулы. |
| Карбоксильная группа | Состоит из атомов углерода, кислорода и связанного с ними атома водорода. Характерные соединения: карбоновые кислоты и их производные. | Обычно располагается на конце углеродной цепи или внутри молекулы. |
Анализ функциональных групп позволяет определить основание химического соединения и предсказать его реакционную способность и свойства.
Определение группы вещества
Существует несколько основных групп веществ, к которым можно отнести химические соединения:
| Группа вещества | Примеры соединений |
|---|---|
| Органические соединения | Метан (CH4), этанол (C2H5OH), бензол (C6H6) |
| Неорганические соединения | Карбонат натрия (Na2CO3), оксид кальция (CaO), хлорид калия (KCl) |
| Соли | Хлорид натрия (NaCl), сульфат магния (MgSO4), карбонат кальция (CaCO3) |
| Кислоты | Серная кислота (H2SO4), соляная кислота (HCl), уксусная кислота (CH3COOH) |
| Основания | Гидроксид натрия (NaOH), гидроксид аммония (NH4OH), гидроксид калия (KOH) |
| Оксиды | Оксид железа (Fe2O3), оксид алюминия (Al2O3), оксид кремния (SiO2) |
Определение группы вещества позволяет понять его основные свойства и применение в различных процессах и реакциях. Кроме того, знание группы вещества помогает проводить более точный анализ и исследование соединения.
Определение валентности элементов

Определение валентности элементов осуществляется путем анализа их электронной конфигурации и положения в периодической системе элементов. Валентность элементов легко определить для некоторых элементов, таких как алкалии и щелочноземельные металлы, у которых валентность равна их номеру группы в периодической системе (например, натрий из группы 1 имеет валентность +1, магний из группы 2 имеет валентность +2).
Однако для некоторых элементов определение валентности может быть сложнее из-за наличия нескольких возможных вариантов. Например, у некоторых переходных металлов валентность может изменяться в зависимости от условий реакции.
Для определения валентности элементов также можно использовать информацию о составе и свойствах соединений, в которых они участвуют. Например, если известна формула химического соединения, можно вывести уравнение реакции и определить количество электронов, которые участвуют в образовании связи между элементами.
Дополнительно можно обратиться к таблице валентностей элементов, в которой указаны обычные валентности для каждого элемента.
| Элемент | Обычная валентность |
|---|---|
| Водород (H) | +1 |
| Кислород (O) | -2 |
| Углерод (C) | +4 |
| Азот (N) | -3 |
Это только некоторые примеры, и валентности элементов могут изменяться в зависимости от конкретного соединения и условий реакции.
Поиск аналогов и анализ свойств

Для поиска аналогов можно воспользоваться химическими базами данных, такими как PubChem или ChemSpider. Они содержат информацию о тысячах соединений, и поиск в них осуществляется по различным критериям, включая формулу.
После нахождения аналогов необходимо провести анализ их свойств. Это включает оценку таких характеристик, как физическая состояние соединения (твёрдое, жидкое или газообразное), температура плавления и кипения, плотность, вязкость и другие. Также важно изучить химические свойства соединений, такие как продукты сгорания, реакционная способность и химическая стабильность.
Анализ аналогов и их свойств позволяет сделать предположения о возможном составе и свойствах исследуемого химического соединения. Такой подход облегчает процесс определения основания и помогает сократить количество возможных вариантов.
Практическое применение

Определение основания химического соединения по формуле имеет широкое практическое применение в химической промышленности и научных исследованиях. Знание основания позволяет предсказывать свойства и реакционную способность соединения, а также разрабатывать методы получения и применения в различных отраслях.
Так, например, в фармацевтической промышленности определение основания химического соединения позволяет предсказывать его взаимодействия с биологическими молекулами, анализировать его фармакологические свойства и разрабатывать новые лекарственные препараты.
В области материаловедения определение основания химического соединения помогает разрабатывать новые материалы с определенными свойствами, такие как прочность, эластичность, проводимость и другие.
Также определение основания химического соединения используется при проведении химических анализов, в особенности качественного анализа, где необходимо определить наличие или отсутствие определенного основания в исследуемом образце.