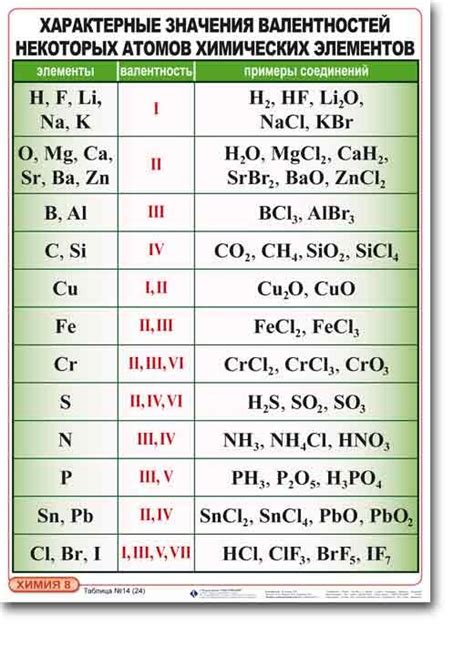
Определение переменной валентности элементов в химии является одной из ключевых задач для понимания и изучения реакций и соединений. Валентность, или степень окисления, элемента указывает на количество электронов, которые он может потерять или получить при участии в химических реакциях. Знание валентности элементов помогает предсказывать и понимать образование и распад соединений, а также позволяет составлять химические уравнения и решать различные задачи.
Существуют различные способы определения валентности элементов. Один из них основан на знании электронной конфигурации элемента. Электронная конфигурация показывает распределение электронов по энергетическим уровням и оболочкам атома. Валентность элемента может быть определена по количеству электронов на внешней энергетической оболочке. Например, элемент со свободными 4 электронами на внешней оболочке имеет валентность +4, а элемент с 3 электронами на внешней оболочке имеет валентность -3.
Другой способ определения валентности элементов - это анализ их химических свойств и реакций. Некоторые элементы имеют постоянную валентность, которая обуславливается их положением в периодической системе. Например, натрий всегда имеет валентность +1, а кислород всегда имеет валентность -2. Однако, многие элементы имеют переменную валентность в зависимости от условий и окружающей среды. Для определения переменной валентности можно использовать соответствующие химические реакции и уравнения, а также таблицы валентностей элементов.
Валентность элементов является важным понятием в химии, и определение ее играет важную роль при изучении соединений и реакций. Знание валентности элемента позволяет предсказывать его поведение в химических реакциях, определять стехиометрию реакций и расчеты количества реагентов и продуктов. Понимание переменной валентности элементов открывает много возможностей для изучения и практического применения химии.
Определение валентности в химии: простое объяснение шаг за шагом

Валентность элемента в химии определяет количество электронов, которые он может отдать или принять во время химической реакции, чтобы образовать стабильные химические связи.
Определение валентности элемента может быть произведено следующим образом:
1. Определите состояние окисления элемента в соединении. Состояние окисления элемента - это электрический заряд, который он принимает в соединении.
2. Известно, что общая сумма состояний окисления всех элементов в соединении равна нулю. Для ионов общая сумма состояний окисления будет равна заряду иона.
3. Предположим, что валентность элемента равна "x", где "x" - неизвестное значение.
4. Умножьте валентность элемента на количество элементов этого вида в соединении и сложите результаты для всех элементов. Это должно дать общую сумму состояний окисления.
5. Если общая сумма состояний окисления соответствует известной сумме, значит, предположение о валентности элемента верно. Если нет, нужно изменить предположение о валентности и повторить шаги.
Пример: Рассмотрим воду (H2O) и предположим, что валентность кислорода (O) равна "x".
Так как в воде два атома водорода (H), общая сумма состояний окисления будет: (2 * 1) + (1 * x) = 0
Мы знаем, что состояние окисления водорода равно +1, поэтому у нас есть: 2 + x = 0
Решив уравнение, мы получаем x = -2. Это означает, что валентность кислорода в воде равна -2.
Таким образом, определение валентности элементов в химии может быть достигнуто с использованием простого шага за шагом метода, который базируется на состоянии окисления элемента и общей сумме состояний окисления всех элементов в соединении.
Что такое валентность в химии и почему она важна?

Валентность позволяет определить, какие ионы может образовать элемент и в каких количествах. Знание валентности элементов не только помогает предугадать их химическое поведение, но и позволяет строить схемы реакций, предсказывать термическую устойчивость соединений и рассчитывать энергию, связанную с образованием и разрушением связей.
Валентность также связана с электроотрицательностью элементов. Элементы с различной валентностью имеют разную способность притягивать электроны в химической связи, что определяет химическую активность и ионизацию элементов.
Таким образом, знание валентности элементов является важным инструментом для понимания и работы с химическими соединениями. Оно позволяет предсказывать свойства веществ, строить химические реакции и разрабатывать новые материалы и технологии.
Как определить валентность ионов? Полезные советы

Вот несколько полезных советов по определению валентности ионов:
- Изучите электронную конфигурацию элемента. Это поможет вам понять, какие электроны участвуют в химической реакции и какие ионы они могут образовывать. Например, элементы с окончательной электронной конфигурацией ns^2np^6 могут иметь валентность -2.
- Изучите ионические соединения, в которых элемент участвует. Анализируйте заряды ионов и их соотношение. Например, если элемент образует соединение с ионом зарядом -2, то его валентность может быть +2.
- Обратите внимание на ионы с аналогичным расположением в периодической системе элементов. Обычно ионы в одной группе имеют схожую валентность. Например, алкальные металлы (группа 1) образуют ионы с валентностью +1.
- Изучите химические свойства и характеристики элемента. Некоторые элементы имеют фиксированную валентность, основанную на их положении в периодической системе и химических свойствах. Например, алюминий (Al) всегда имеет валентность +3.
- Используйте таблицу валентностей элементов для быстрого определения валентности ионов. В такой таблице указаны основные валентности для различных элементов.
С помощью этих советов и знаний о периодической системе элементов вы сможете легко определить валентность ионов и лучше понять химические свойства веществ.
Определение полярной и неполярной валентности
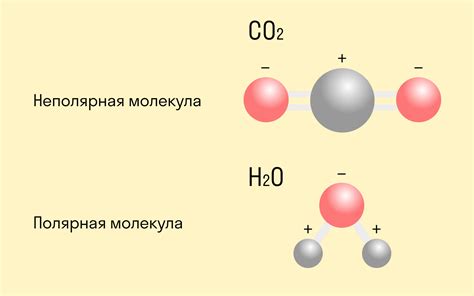
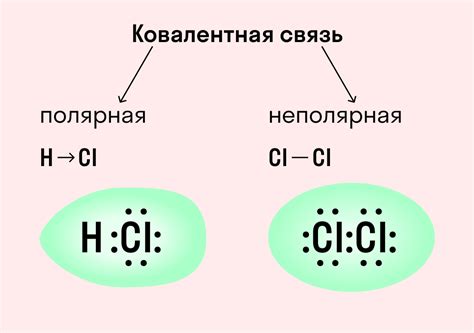
Одной из разновидностей валентности является так называемая полярная валентность. Полярная валентность характеризуется наличием полярных ковалентных связей - связей, в которых электроны общей пары не проводятся между двумя атомами равномерно, а смещаются ближе к одному из атомов. Это происходит из-за различной электроотрицательности атомов, то есть их способности притягивать электроны. Атом с большей электроотрицательностью будет иметь отрицательную полярность, а атом с меньшей электроотрицательностью будет иметь положительную полярность.
Неполярная валентность, в свою очередь, характеризуется отсутствием полярных связей. В неполярных связях электроны общей пары равномерно распределены между атомами, так как они имеют одинаковую или очень близкую электроотрицательность.
Определение полярности или неполярности валентности элементов в химии важно для понимания и предсказания их химических свойств и реакционной способности. Изучение валентности и полярности связей является основой для понимания химических реакций и построения реакционных механизмов.
Как использовать таблицу Менделеева для определения валентности
Определение валентности элементов основывается на их положении в таблице Менделеева. Валентность - это число, которое указывает, сколько электронов может принять или отдать атом элемента при образовании химических связей.
Для определения валентности элемента можно воспользоваться следующими правилами:
1. Группа элемента
Группа элемента указывает на количество электронов в его внешней оболочке. Элементы в одной группе имеют одинаковую валентность. Например, элементы группы 1 имеют валентность +1, а элементы группы 2 - +2.
2. Период элемента
Период элемента указывает на количество электронных оболочек, которые есть у атома элемента. Валентность элементов, находящихся в одном периоде, может варьироваться. Например, элементы первого периода (водород и гелий) имеют валентность +1 и 0 соответственно.
3. Информация из таблицы Менделеева
Из таблицы Менделеева можно получить дополнительную информацию о валентности элементов. Некоторые элементы имеют постоянную валентность, которая указана над их символами в таблице. Например, кислород всегда имеет валентность -2, а алюминий - +3.
4. Электронная конфигурация элемента
Электронная конфигурация элемента указывает на распределение электронов по его энергетическим уровням. Из нее можно определить валентность элемента, основываясь на правиле октаета: стабильная электронная конфигурация внешней оболочки достигается, когда в ней находится 8 электронов. Если внешняя оболочка не заполнена, элемент может принять или отдать электроны, чтобы достичь стабильности.
Важно помнить, что указанные правила являются общими и могут быть исключениями в некоторых случаях. Более детальную информацию о валентности элементов можно найти в учебниках по химии или других источниках.
Связь между валентностью и химическими реакциями
Валентность элемента определяет его способность образовывать химические связи с другими элементами в химических соединениях. Эта связь имеет прямое влияние на типы и свойства химических реакций.
Когда элемент имеет одну валентность, он может образовывать только один тип связи с другими элементами. Например, хлор (Cl) имеет валентность 1 и может образовывать только одноатомные ионные соединения, такие как хлорид натрия (NaCl).
Однако большинство элементов имеют несколько возможных валентностей, что позволяет им образовывать различные типы связей. Например, железо (Fe) может иметь валентность 2 или 3. Когда оно имеет валентность 2, оно образует соединения с ионами, имеющими валентность -2, такими как оксид серы (FeS). Когда железо имеет валентность 3, оно образует соединения с ионами, имеющими валентность -3, например, хлорид железа (FeCl3).
Изменение валентности элементов в химической реакции происходит при образовании или разрыве химических связей. Это позволяет элементам образовывать новые соединения и претерпевать превращения в процессе реакции. Например, в процессе окислительно-восстановительной реакции между железом и серой, железо окисляется и его валентность изменяется с 2 на 3, а сера восстанавливается и ее валентность изменяется с -2 на -3.
Таким образом, валентность элементов играет важную роль в процессе химических реакций, определяя типы связей и химические превращения, которые могут происходить между элементами.
Примеры определения валентности в простых соединениях
Пример 1:
Рассмотрим соединение между атомами кислорода и водорода, известное как вода (H2O). В данном случае кислород образует две валентные связи, а водород – одну. Валентность атома кислорода в воде составляет -2, так как он электроотрицателен и образует ковалентные связи с водородом. Валентность атома водорода в данном случае равна +1, так как он образует одну положительно заряженную связь с кислородом.
Пример 2:
Рассмотрим соединение между атомами кальция и кислорода, известное как кальций оксид (CaO). В данном случае кальций образует одну валентную связь, а кислород – две. Валентность атома кальция в кальции оксиде составляет +2, так как он образует одну положительно заряженную связь с кислородом. Валентность атома кислорода в данном случае равна -2, так как он образует две отрицательно заряженные связи с кальцием.
Пример 3:
Рассмотрим соединение между атомами алюминия и хлора, известное как алюминий хлорид (AlCl3). В данном случае алюминий образует три валентные связи, а хлор – одну. Валентность атома алюминия в алюминии хлориде составляет +3, так как он образует три положительно заряженные связи с хлором. Валентность атома хлора в данном случае равна -1, так как он образует одну отрицательно заряженную связь с алюминием.
Это только некоторые примеры, которые помогут вам понять, как определить валентность в простых соединениях. В реальности могут быть различные вариации и исключения, поэтому всегда следует обращаться к соответствующим источникам и таблицам для определения валентности элементов в более сложных соединениях.
Сложные примеры определения валентности в неорганических соединениях

Определение валентности элементов в неорганических соединениях может быть сложным заданием, особенно в случае, когда в соединении присутствуют несколько атомов одного элемента или атомы разных элементов с различными валентностями.
Рассмотрим несколько примеров сложных соединений и методов определения валентности элементов:
- Азот в нитрате аммония (NH4NO3)
- Железо в гидроксиде железа(II) (Fe(OH)2)
- Кислород в пероксиде водорода (H2O2)
В данном соединении азот (N) может иметь валентности +5 (в нитратной группе NO3) и -3 (в аммониевой группе NH4). Чтобы определить валентность азота, нужно учесть общий заряд соединения. В данном случае, исходя из зарядов аммония (+1) и нитрата (-1), азот должен иметь валентность +5.
В данном соединении железо (Fe) может иметь валентности +2 (в гидроксидной группе OH) и +3 (в железной группе Fe). Чтобы определить валентность железа, нужно учесть общий заряд соединения. В данном случае, исходя из зарядов гидроксида (-1) и железа (+2), железо должно иметь валентность +2.
В данном соединении кислород (O) может иметь валентности -1 (в группе OH) и -2 (в группе O). Чтобы определить валентность кислорода, нужно учесть общий заряд соединения. В данном случае, исходя из зарядов водорода (+1) и кислорода (-1), кислород должен иметь валентность -1.
В редких случаях определение валентности элементов может быть более сложным и требует знания специфических правил и свойств соединений. В таких случаях рекомендуется обратиться к специальной литературе или проконсультироваться с опытным химиком.
Химический эксперимент: определение валентности с помощью электролиза

Электролиз основан на применении электрического тока для приведения химической реакции в движение и разделения атомов элемента на положительные и отрицательные ионы. Во время проведения эксперимента, вещество, содержащее атомы интересующего нас элемента, помещается в электролитическую ячейку, где оно разлагается под воздействием электрического тока.
Во время электролиза отрицательно заряженные ионы перемещаются к аноду, а положительно заряженные ионы перемещаются к катоду. Скорость перемещения ионов зависит от их заряда и массы. Используя эту информацию, можно определить валентность элемента.
Валентность элемента равна независимому десятичному числу, показывающему, сколько атомов водорода может отдать или принять атом данного элемента при образовании соединений. Например, валентность кислорода в соединении H₂O равна 2, так как он способен принять 2 атома водорода. Валентность некоторых элементов может изменяться в зависимости от окружающих условий и состава химического соединения.
Электролиз является мощным и универсальным методом определения валентности элементов в химии. Он позволяет быстро и точно определить, сколько электронов может отдать или принять атом заданного элемента, и установить валентность элемента в химическом соединении.
Практические применения определения валентности в промышленности

Одним из практических применений определения валентности в промышленности является проектирование электролизных процессов. Валентность элементов влияет на эффективность электролиза, определяет степень окисления и восстановления веществ, а также позволяет контролировать процесс электродефункции. Благодаря определению валентности элементов, можно улучшить производство таких важных продуктов, как алюминий, хлор и кислород.
Еще одним применением определения валентности является разработка катализаторов для химической промышленности. Валентность элементов важна для понимания химических реакций, происходящих на поверхности катализатора, и выбора оптимального состава катализатора. Например, при производстве аммиака используется катализатор, содержащий железо со валентностью +3 и молибден со валентностью +6.
Также определение валентности находит применение в производстве аккумуляторов и элементов электрохимических систем. Знание валентности элементов позволяет оптимизировать состав и процессы образования электродов, что улучшает энергетическую эффективность и долговечность аккумуляторов. Например, при производстве литиевых и никель-кадмиевых аккумуляторов используется определение валентности для выбора оптимального катализатора и регулировки химического потенциала электродов.
| Определение валентности элементов в промышленности | Применение в химических процессах |
|---|---|
| Проектирование электролизных процессов | Улучшение производства алюминия, хлора и кислорода |
| Разработка катализаторов | Повышение эффективности химических реакций |
| Производство аккумуляторов | Улучшение энергетической эффективности и долговечности |
Завершение: знание валентности – ключ к пониманию химических процессов
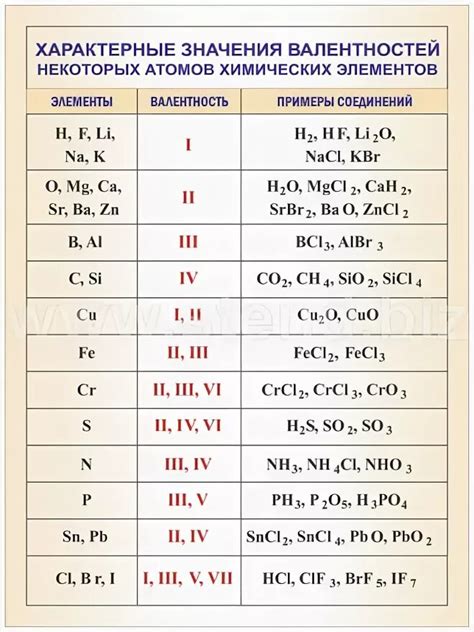
Правильное определение валентности позволяет предсказывать реакции между элементами и создавать химические соединения. Например, зная валентность элементов, можно определить, какой ион будет образовываться при реакции с другим элементом.
Кроме того, знание валентности позволяет определить степень окисления атомов в химических соединениях. Это важно для решения различных химических задач и расчетов.
Определение валентности элементов можно проводить на основе их положения в периодической системе элементов, а также с помощью знания основных правил и закономерностей валентности. Знание этих правил помогает понять, какие ионы и соединения образуются при взаимодействии различных элементов.
Итак, знание валентности элементов является важным инструментом в химии и позволяет понимать и предсказывать различные химические процессы. В дальнейшем изучении химии, глубокое понимание валентности станет ключом к успешной работе с химическими реакциями и соединениями.