Молярная доля вещества в растворе является одним из основных понятий в химии. Это величина, которая показывает, какое количество вещества содержится в данном растворе. Определение молярной доли важно для проведения различных химических расчетов и анализа.
Молярная доля выражается числом от 0 до 1 и обозначается как X. Если X = 0, это означает, что данная вещества в растворе отсутствует, X = 1 говорит о том, что весь раствор состоит из данной вещества. В промежутке от 0 до 1 молярная доля показывает, какую долю составляет данное вещество в растворе.
Для определения молярной доли вещества в растворе необходимо знать количество вещества данного вещества и общее количество вещества в растворе. Молярная доля рассчитывается по формуле:
X = n(вещество) / n(общее)
Где n(вещество) - количество вещества данного вещества в растворе, а n(общее) - общее количество вещества в растворе.
Молярная доля вещества в растворе: что это такое?

Молярная доля вещества в растворе считается по формуле:
| Молярная доля вещества | = | количество вещества (моль) | / | количество раствора (моль) |
Обычно молярную долю вещества обозначают символом X или обычной буквой "х". Например, молярная доля соли в растворе будет равна количеству соли в молях, деленному на общее количество раствора в молях.
Знание молярной доли вещества в растворе позволяет более точно определить его концентрацию и осуществлять требуемые расчеты при подготовке растворов. Этот показатель также широко используется в химических исследованиях, анализе и при производстве различных химических соединений.
Расчет молярной доли

Молярная доля вещества в растворе представляет собой отношение молей данного вещества к общему числу молей всех компонентов раствора. Для расчета молярной доли необходимо следовать нескольким шагам:
- Определить массу каждого компонента раствора.
- Вычислить количество вещества каждого компонента, разделив его массу на молярную массу данного вещества.
- Сложить количество вещества каждого компонента, чтобы получить общее количество вещества в растворе.
- Рассчитать молярную долю искомого вещества, разделив количество вещества данного вещества на общее количество вещества в растворе и умножив на 100%.
Например, для раствора содержащего 10 г кислоты HCl и 20 г воды H2O, молярная доля кислоты будет равна:
- Масса HCl: 10 г
- Масса H2O: 20 г
- Количество вещества HCl: 10 г / молярная масса HCl
- Количество вещества H2O: 20 г / молярная масса H2O
- Общее количество вещества: Количество вещества HCl + Количество вещества H2O
- Молярная доля HCl: (Количество вещества HCl / Общее количество вещества) * 100%
Как определить молярную долю экспериментально?

Если вам нужно определить молярную долю вещества в растворе, вы можете воспользоваться экспериментальными методами. Вот несколько шагов, которые помогут вам выполнить эту задачу:
- Измерьте массу образца вещества и добавьте его в известный объем растворителя. Обычно для этого используют весы и мерный сосуд.
- Тщательно перемешайте раствор и образец, чтобы убедиться, что вещество полностью растворено.
- Возьмите небольшой образец раствора с известным объемом (например, с помощью мерного пипетки) и поместите его в прибор для измерения массы.
- Определите массу этого образца раствора. Учтите, что при проведении эксперимента важно точно измерить массу и объем, чтобы получить достоверные результаты.
- Используя полученные данные о массе, объеме и молярной массе вещества, вы сможете определить молярную долю экспериментально.
- Повторите эксперимент несколько раз для получения более точных результатов.
Эти шаги помогут вам определить молярную долю вещества в растворе с помощью эксперимента. Помните, что точность и надежность результатов зависят от тщательности и аккуратности выполнения каждого шага.
Факторы, влияющие на молярную долю вещества

Существует несколько факторов, которые могут влиять на молярную долю вещества в растворе:
1. Концентрация раствора: Чем больше количество вещества в определенном объеме раствора, тем выше молярная доля. Концентрация раствора может быть высокой или низкой в зависимости от количества растворенного вещества.
2. Температура: В некоторых случаях, изменение температуры может привести к изменению молярной доли вещества в растворе. Например, некоторые растворы могут стать насыщенными или ненасыщенными при изменении температуры.
3. Растворимость вещества: Растворимость вещества - это способность вещества растворяться в данном растворителе. Если вещество хорошо растворимо, то его молярная доля будет высокой. В случае, когда вещество плохо растворимо, его молярная доля будет низкой.
4. Давление: Для большинства растворов, изменение давления не оказывает значительного влияния на их молярную долю вещества. Однако, для некоторых газовых растворов изменение давления может изменить их молярную долю.
Учет этих факторов позволяет определить молярную долю вещества в растворе и понять, какие условия могут повлиять на ее величину.
Практические примеры определения молярной доли вещества
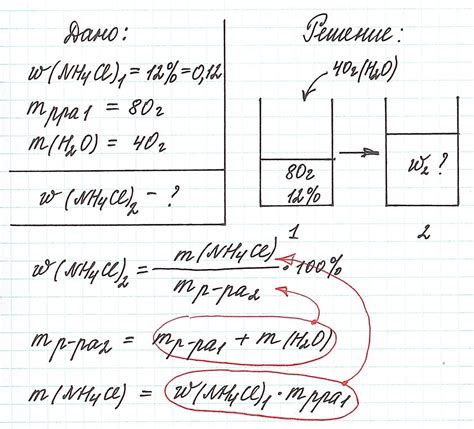
Пример 1:
В растворителе содержится 0.5 моль HCl и 2 моль H2O. Найдем молярную долю HCl в этом растворе.
Для расчета молярной доли вещества необходимо найти мольные доли каждого компонента раствора.
Молярная доля HCl = (моль HCl) / (моль HCl + моль H2O)
Молярная доля HCl = 0.5 / (0.5 + 2) = 0.2
Таким образом, молярная доля HCl в данном растворе составляет 0.2 или 20%.
Пример 2:
В растворе содержится 0.1 моль NaCl и 0.2 моль H2O. Найдем молярную долю NaCl в этом растворе.
Молярная доля NaCl = (моль NaCl) / (моль NaCl + моль H2O)
Молярная доля NaCl = 0.1 / (0.1 + 0.2) = 0.1
Таким образом, молярная доля NaCl в данном растворе составляет 0.1 или 10%.
Пример 3:
В растворе содержится 0.05 моль C6H12O6 и 0.1 моль H2O. Найдем молярную долю C6H12O6 в этом растворе.
Молярная доля C6H12O6 = (моль C6H12O6) / (моль C6H12O6 + моль H2O)
Молярная доля C6H12O6 = 0.05 / (0.05 + 0.1) = 0.3333
Таким образом, молярная доля C6H12O6 в данном растворе составляет 0.3333 или примерно 33.33%.
Польза определения молярной доли вещества в растворе

Определение молярной доли вещества в растворе позволяет:
- Определить концентрацию вещества в растворе: молярная доля показывает, сколько молей определенного вещества содержится в 1 кг раствора. Это важно для определения концентрации исследуемого вещества и его использования в различных химических процессах.
- Провести точный расчет реакций: зная молярную долю вещества в растворе, можно провести точные расчеты стехиометрических реакций. Это позволяет определить необходимые пропорции веществ для проведения определенной реакции и получить желаемый продукт.
- Определить физические и химические свойства раствора: молярная доля вещества в растворе может влиять на его физические и химические свойства. Зная эту величину, можно предсказать поведение раствора при изменении условий и проводить необходимые эксперименты.
- Контролировать качество и стандартизацию растворов: определение молярной доли вещества в растворе позволяет контролировать качество и стандартизацию растворов. Это критически важно для медицинских и фармацевтических препаратов, а также в других областях, где точность растворов имеет важное значение.
Таким образом, определение молярной доли вещества в растворе является неотъемлемой частью химических исследований и находит применение во многих областях науки и техники.
Молярная доля вещества и её важность в химии

Молярная доля выражается в виде десятичной дроби или процента. Она позволяет исследователям получить информацию о количестве вещества, атомов или молекул, которые участвуют в химической реакции или образуют раствор.
Знание молярной доли вещества в растворе особенно важно в химии, так как оно позволяет определить степень концентрации определенного вещества в растворе. Это позволяет проводить точные эксперименты, а также оптимизировать процессы смешивания и растворения веществ.
Молярная доля также является важным понятием при изучении количественных законов химии, таких как закон Дальтона и закон Вольтера.
Определение молярной доли вещества в растворе может быть выполнено различными методами, включая гравиметрический и волюметрический анализ. Эти методы позволяют получить точные значения молярной доли и использовать их для дальнейших расчетов и экспериментов.
Применение молярной доли в реакциях
Молярная доля выражается в виде десятичной дроби и показывает, какая часть общего количества вещества в растворе относится к определенному веществу. Например, если молярная доля вещества А равна 0,5, это означает, что половина общего количества вещества в растворе относится к веществу А.
В реакциях молярная доля вещества используется для расчета необходимого количества реагентов. Зная молярные доли каждого вещества в растворе и балансованный уравнение реакции, можно определить соотношение между веществами и рассчитать необходимое количество вещества для проведения реакции.
Например, если в уравнении реакции указано, что для каждой молекулы вещества А требуется 2 молекулы вещества В, можно использовать молярные доли веществ в растворе, чтобы определить необходимое количество вещества. Если молярная доля вещества А равна 0,4, а молярная доля вещества В равна 0,6, то можно рассчитать, что для образования 1 молекулы вещества А необходимо 1,5 молекулы вещества В.
Применение молярной доли в реакциях позволяет проводить расчеты и оптимизировать использование реагентов. Также она является основой для рассчета концентрации вещества в растворе, что помогает контролировать процесс проведения химической реакции и получать желаемый результат.